Жизнь после правды: как прокурор пошла против системы.
В 2005 года зам. прокурора Железнодорожного района Хабаровска Татьяна Ламаш рассказала местным журналистам об «оборотнях в погонах». И после этого начался административный ад…
Это вызвало скандал всероссийского масштаба: репортажи о Татьяне Ламаш шли по всем центральным телеканалам, в краевой прокуратуре «полетели головы». Что героине сюжетов пришлось пережить тогда и как сложилась ее жизнь после?
Предыстория
Весной 2005 года Хабаровской природоохранной прокуратурой было возбуждено уголовное дело по фактам контрабанды в КНР леса в отношении некоего ООО. Руководство фирмы обратилось за помощью в прекращении уголовного дела к сотрудникам краевого УВД. 16 мая оперативники ФСБ задержали менеджеров фирмы в момент передачи взятки в 40 тысяч долларов двум высокопоставленным милиционерам.
Изначально уголовное дело о взятке находилось под надзором зампрокурора Железнодорожного района Татьяны Ламаш.
«Многие меня предали»
— В правоохранительных органах нет такого понятия, как «корпоративная солидарность», — говорит Татьяна, — если только ты не член стаи». Если ты стал «белой вороной», жалеть тебя не будут. Поэтому вокруг все с уверенностью заявляли, что я в прокуратуре работать больше не буду, а кто-то даже утверждал, что меня посадят.
Вскоре в отношении нее было действительно сфабриковано уголовное дело. Которое, правда, вскоре развалилось. Ее стали выдавливать из прокуратуры другими методами. — Сначала завалили работой – до такой степени, чтобы я перестала справляться. Но я сидела на работе до упора, по ночам. Ну и, конечно, мне помогали люди, которые были на моей стороне. Тогда руководство применило другой метод – сокращение.
Ну и, конечно, мне помогали люди, которые были на моей стороне. Тогда руководство применило другой метод – сокращение.
Татьяна Ламаш была отправлена в отставку в июле 2006 года. После московской ревизии ей удалось продержаться чуть больше полугода.
— Прошло уже 2,5 года, и за все это время не было ни дня, чтобы я не прокручивала эту ситуацию в голове, не анализировала. Знаете, ведь со временем наше отношение ко всему меняется. Но к той ситуации мое отношение со временем совершенно не изменилось, я по-прежнему считаю, что не могла поступить иначе.
Признается, что в то время потеряла нескольких людей из тех, кого считала друзьями.
— Я их понимаю: у всех семьи, работа, которую не хочется терять. Но есть то, что меня греет больше всего: мои ребята-следователи меня не предали. Я знаю, через что им пришлось пройти: с ними проводились «задушевные» беседы, их заставляли подписывать заявления против меня. Но они выдержали, не сломались, хотя некоторым из них и пришлось уйти из прокуратуры или перевестись в другие города.
А не сломаться самой Татьяне Ламаш помог еще один человек – муж Владимир, которому, кстати, из-за всей этой ситуации тоже пришлось уйти из правоохранительных органах.
— Конечно, были люди, которые меня поддерживали. Но по вечерам все шли по своим делам, а я оставалась наедине со своими мыслями. И если бы не поддержка мужа, даже не знаю, выдержала ли бы я все это. Как-то я завела разговор о том, не зря ли я пошла на это, не лучше ли было принять условия начальства. На что он сказал: «Даже не думай, ты все сделала правильно, иначе ты себя просто бы потеряла, сломала. Сама себе бы не простила».
Гордыня?
Чтобы избавиться от сомнений, Татьяна даже разговаривала со священником.
— И он сказал мне, что в определенной степени мной руководила гордыня. И я согласилась с этим. Ведь если бы я не пошла, по его мнению, на принцип, я бы не только сохранила свое здоровье, работу, но и уберегла бы от прессинга близких людей. Разговаривая со священником, я поняла смысл библейской мудрости о том, чтобы подставить левую щеку, после того, как тебя ударили по правой. Справедливость этого изречения подтверждает и то, что я ничего не добилась: хуже стало только мне и моим близким. Но в том-то и дилемма, что я не шла на принцип. Я просто верила в то, что делала.
Разговаривая со священником, я поняла смысл библейской мудрости о том, чтобы подставить левую щеку, после того, как тебя ударили по правой. Справедливость этого изречения подтверждает и то, что я ничего не добилась: хуже стало только мне и моим близким. Но в том-то и дилемма, что я не шла на принцип. Я просто верила в то, что делала.
Те сотрудники прокуратуры, которые были причастны к этому делу, сначала, после московской проверки, были уволены. Через некоторое время они были вновь приняты, но на более высокие должности. Тогдашний прокурор края после московской проверки получил взыскание о неполном служебном соответствии. Но вскоре был повышен — стал замом генпрокурора по Центральному федеральному округу.
— Поэтому, когда мне говорят, что в системе правоохранительных органов – сплошная коррупция, я говорю, – нет, коррупция – это и есть сама система. Это норма и стиль жизни. У нас «дают» не только за то, чтобы нарушали закон, но и за то, чтобы его исполняли.
Жизнь после
— Естественно, мне было жаль уходить из следствия. Я ведь работала просто остервенело, порой в ущерб семье – так любила свое дело. И мне пришлось его бросить. По этому поводу я переживала больше всего. К тому же был страх, что не найду теперь работу.
К счастью, ей предложили работу – такую, где и профессиональные навыки пригодились, и интересную. Во всяком случае, сама Татьяна Ламаш после двух лет работы в коллекторском бюро, говорит о своей работе с не меньшим интересом, чем о следствии.
— У нас очень талантливая, молодая команда и, кстати, немало людей, ранее работавших в правоохранительных органах. Много приходится ездить по стране, а я всегда мечтала путешествовать. Раньше я жила, чтобы работать, а теперь работаю, чтобы жить.
По словам Татьяны, до сих пор многие знакомые воспринимают тот ее поступок как некий подвиг.
— Но у меня самой ощущения подвига нет. Для меня очень важно такое понятие, как профессиональная честь, хотя кому-то в это и трудно поверить. И у меня никогда не было какой-то обиды за то, что со мной произошло. Но боль, несомненно, осталось. И жизнь моя теперь делится на «до» и «после»…
Татьяна Владина, «АиФ-Дальинформ»
Банки проверят мобильные номера клиентов//Известия
Уже в этом году должен появиться механизм, позволяющий банкам выяснять, принадлежит ли мобильный номер конкретному гражданину. Оператором этой системы может стать Институт связи (ЦНИИС). Об этом рассказал «Известиям» глава Национального совета по финансовому рынку (НСФР) Андрей Емелин. Благодаря новому методу проверки можно будет уменьшить риски краж персональных данных клиентов кредитных организаций. Это также поможет оградить их от общения с коллекторами по чужим долгам.
В 2018 году банки смогут отслеживать «чистоту» использования мобильных номеров их клиентами. То есть устанавливать, принадлежит ли номер сотового телефона конкретному гражданину. Это станет возможно благодаря созданию системы проверки телефонов, рассказал «Известиям» председатель НСФР Андрей Емелин. По его словам, участники совета решили запустить ее на базе ЦНИИС. В институте рассказали, что такие обсуждения велись, не уточнив детали.
То есть устанавливать, принадлежит ли номер сотового телефона конкретному гражданину. Это станет возможно благодаря созданию системы проверки телефонов, рассказал «Известиям» председатель НСФР Андрей Емелин. По его словам, участники совета решили запустить ее на базе ЦНИИС. В институте рассказали, что такие обсуждения велись, не уточнив детали.
По словам главы НСФР, процесс будет устроен следующим образом. Банк передает в ЦНИИС в зашифрованном виде сведения о клиенте — ФИО, номер паспорта и номер телефона. Затем оператор направляет данные для сверки в сотовую компанию и дает ответ кредитной организации, достоверна ли ее информация.
Выбор института в качестве площадки для создания системы обусловлен тем, что он уже выступает оператором базы данных перенесенных абонентских номеров. Ее создали в декабре 2013 года, когда россиянам разрешили менять сотовую компанию, сохраняя номер телефона. За четыре года этой услугой воспользовались более 7,5 млн абонентов. В работу ЦНИИС легко встроить системы передачи данных от банков, отметил Андрей Емелин.
Мониторинг номеров нужен и банкам, и клиентам, убежден глава движения «СтопСпам» Денис Калугин. Институт проверки «чистоты» номеров поможет снизить риски мошенничества при обслуживании клиентов кредитных организаций. Хакеры часто делают дубликаты SIM-карт и крадут данные о счетах граждан, пояснил финансист.
Также система поможет защитить граждан от общения с коллекторами по чужим долгам. Ежемесячно взыскатели отправляют 100 млн SMS. Треть из них попадает к совершенно другим людям, доставляя им серьезные неудобства, пояснила управляющий партнер аудиторской компании «2К» Тамара Касьянова.
Она добавила, что нововведение позволит при смене владельца мобильного номера сразу же отключать SMS-уведомления от банков и рассылки, предназначенные предыдущему владельцу. Это предотвратит лишние траты клиентов кредитных организаций на информирование.
В ЦБ, Минкомсвязи и МТС не ответили на вопрос «Известий», поддерживают ли инициативу участников финрынка. Банкиры и сотовые операторы в целом позитивно отнеслись к идее.
Директор Азиатско-Тихоокеанского банка по розничным кредитным рискам Олег Коротун отметил, что система проверки номеров нужна для дополнительной идентификации граждан, которые обращаются в кредитную организацию удаленно. Она будет актуальной и при выдаче займов, добавил он.
Если удастся связать номер мобильного телефона с паспортом, то кредитные организации смогут упростить и улучшить дистанционное обслуживание клиентов. Это подстегнет рост продаж банковских продуктов, считает начальник отдела мобильных сервисов Бинбанка Алексей Курзяков.
— Мы изначально выступали за прямое взаимодействие банков и операторов, — отметили в пресс-службе «Билайна».
Наряду с плюсами создания системы проверки номеров в «Мегафоне» видят и минусы. Они касаются информационной безопасности. Ведь всем банкам и операторам связи придется обмениваться сведениями. Кроме того, неясен механизм финансирования такой системы, а также тарификации централизованного обмена.
Кроме того, неясен механизм финансирования такой системы, а также тарификации централизованного обмена.
Запуск специальной системы проверки телефонов банковских клиентов может стать еще одной мерой в борьбе с хакерами и недобросовестными клиентами банков. Ранее депутаты Госдумы приняли закон, который обязывает сотовых операторов блокировать по требованию правоохранительных органов номера телефонных террористов. Также нормативный акт требует предоставлять правоохранителям в неизменном виде код абонента или телефонный номер.
ПКБ № 5 — Шизофрения
Шизофрения — хроническое психическое заболевание, для которого характерно нарушение единства процессов мышления, при относительно сохранном интеллекте, что сочетается со значительным эмоциональным обеднением и снижением воли. Нередко присоединяются галлюцинаторные и бредовые расстройства.
Сам термин «шизофрения» составлен из двух греческих слов — «шизо» — раскалываю и «френи» — разум рассудок.
Впервые данный термин был применен швейцарским психиатром Эйгеном Блёйлером в 1908г. Шизофрения, конечно же, существовала и раньше, но только к началу XX-века созрело представление о ней как об особой разновидности психозов.
В массовом сознании существует необоснованное отождествление шизофрении с «раздвоением личности» — то есть, фактически, с очень редким психическим расстройством, при котором в одном человеке попеременно активизируются как бы разные «я».
Шизофрения же, к сожалению, встречается довольно часто. Её распространенность среди населения России составляет 35 на 10 000 человек, без существенной разницы между полами. Таким образом, в России не менее полумиллиона больных с этой серьезной патологией.
Шизофрения относится к эндогенным психическим заболеваниям, это значит, что она является внутренней поломкой психики. Её нельзя вызвать какими-либо факторами, действующими на головной мозг извне (травмой, интоксикацией, сильным стрессом). Конечно, перечисленные факторы могут повлиять на скорость развития шизофрении, но не на ее возникновение. Тем не менее, механизм развития шизофренического процесса пока сколько-нибудь точно не установлен. На этот счет существует несколько гипотез. Так, имеются данные о связи шизофрении с нарушением распределения дофамина в центральной нервной системе.
Тем не менее, механизм развития шизофренического процесса пока сколько-нибудь точно не установлен. На этот счет существует несколько гипотез. Так, имеются данные о связи шизофрении с нарушением распределения дофамина в центральной нервной системе.
Весьма велика роль наследственности. Так, если один из близнецов заболел шизофренией, то риск заболеть для другого близнеца составляет 17% в разнояцевой паре и 48% в однояйцевой. Тем не менее, считается, что в половине случаев шизофрения возникает от случайной мутации, то есть на основе генетических изменений, которые отсутствовали у родителей и появились уже после зачатия.
Симптоматика может развиться в любом возрасте (возможно, даже внутриутробно), но обычно её начало приурочено к третьему пубертатному кризу, то есть — к возрасту 12 — 18 лет или к последующим нескольким годам (примерно, до 30 лет).
Чаще всего, заболевание начинается с негативных симптомов, связанных с утратой нормального функционирования, — человек без видимой причины меняется по характеру, становится замкнутым, отгороженным, теряет социальные контакты, исчезает эмоциональная теплота в отношении к близким. Пропадают прежние интересы, резко снижается успеваемость в школе или в вузе, либо не выполняются служебные обязанности. Таким образом, с самого начала клинических проявлений есть очень большой риск инвалидизации. В наиболее неблагоприятном варианте, который обозначается как простая шизофрения, больной может целыми днями лежать, смотреть в потолок и при ясном сознании и нормальной физической силе не в состоянии элементарно себя обслужить. Даже при более благоприятных вариантах нарастают нарушения мышления, которые выражаются в наплывах мыслей или в ощущении, что мыслей нет вообще. Рассуждения становятся непродуктивными, нецеленаправленными, формируется двойственное отношение к жизненным явлениям (амбивалентность). Речь отличается витиеватостью, иногда — с неологизмами, которые придумывает сам пациент. При разговоре происходят отвлечения от его темы (соскальзывания), причем не на конкретные детали и обстоятельства, а на «плохое» отношение к больному тех или иных персонажей, либо на глобально-философские темы.
Пропадают прежние интересы, резко снижается успеваемость в школе или в вузе, либо не выполняются служебные обязанности. Таким образом, с самого начала клинических проявлений есть очень большой риск инвалидизации. В наиболее неблагоприятном варианте, который обозначается как простая шизофрения, больной может целыми днями лежать, смотреть в потолок и при ясном сознании и нормальной физической силе не в состоянии элементарно себя обслужить. Даже при более благоприятных вариантах нарастают нарушения мышления, которые выражаются в наплывах мыслей или в ощущении, что мыслей нет вообще. Рассуждения становятся непродуктивными, нецеленаправленными, формируется двойственное отношение к жизненным явлениям (амбивалентность). Речь отличается витиеватостью, иногда — с неологизмами, которые придумывает сам пациент. При разговоре происходят отвлечения от его темы (соскальзывания), причем не на конкретные детали и обстоятельства, а на «плохое» отношение к больному тех или иных персонажей, либо на глобально-философские темы. Людям, страдающим шизофренией, свойственно с некоторым цинизмом относиться ко многим аспектам окружающего.
Людям, страдающим шизофренией, свойственно с некоторым цинизмом относиться ко многим аспектам окружающего.
У больных бывает тягостное чувство, что все вокруг какое-то измененное, лишено естественности, гармоничности (- дереализация), такие же ощущения могут возникать в отношении своей личности (- деперсонализация). При деперсонализации сознание (но не личность!) словно раздваивается: одна часть его смотрит на происходящее со стороны, а другая испытывает ужас от осознания потери контроля над собой.
Собственные мысли и представления начинают восприниматься как чуждые. По современным воззрениям, именно поэтому при шизофрении бывают вербальные галлюцинации («голоса»), и неудивительно, что для этого заболевания типично звучание «голосов» внутри головы. По той же причине пациенту кажется, что кто-то управляет им извне, вплоть до управления движениями и работой внутренних органов. Реже бывают видения.
Такая нарастающая волна необычных ощущений очень тягостна. Во многих случаях внутреннее напряжение несколько облегчается за счет формирования бредовых идей (быстро — как озарение — происходит кристаллизация бреда). Больному становится вдруг «ясно», что происходящее с ним — это, например, «происки» какой-то «организации», которая с помощью современной аппаратуры осуществляет «воздействие» на него извне (бред преследования, воздействия). Встречается и бред ревности, ущерба. Понятно, что на фабулу переживаний влияет уровень развития общества, в том числе сюжеты популярных произведений литературы и кино.
Больному становится вдруг «ясно», что происходящее с ним — это, например, «происки» какой-то «организации», которая с помощью современной аппаратуры осуществляет «воздействие» на него извне (бред преследования, воздействия). Встречается и бред ревности, ущерба. Понятно, что на фабулу переживаний влияет уровень развития общества, в том числе сюжеты популярных произведений литературы и кино.
Вся эта клиническая картина зачастую развивается остро, в виде приступа, который длится от нескольких дней до нескольких месяцев, а затем может повторяться. Приступообразные формы шизофрении более благоприятны, в прогностическом плане, чем непрерывные. Промежутки между приступами бывают очень длительными (иногда — десятки лет), и между ними человек выглядит почти как прежде, до болезни. Но это скорее исключение. Гораздо чаще обострения симптоматики повторяются ежегодно или по нескольку раз в год, и и по выходе из каждого нового приступа, оказывается, что еще слабее стала воля и еще больше поблекли эмоции. Постепенно, в течение многих лет, менее актуальными становятся галлюцинаторные переживания. Параллельно, но также весьма медленно, разваливается бред как система псевдо-логических умозаключений, — от бреда остаются отдельные обрывки. В итоге развивается состояние дефекта, которое напоминает простую шизофрению.
Постепенно, в течение многих лет, менее актуальными становятся галлюцинаторные переживания. Параллельно, но также весьма медленно, разваливается бред как система псевдо-логических умозаключений, — от бреда остаются отдельные обрывки. В итоге развивается состояние дефекта, которое напоминает простую шизофрению.
Пациенты либо не признают себя больными, либо имеют противоречивые мысли на этот счет. Как правило, они негативно встречают уговоры близких о необходимости обращения к психиатру. Бывают попытки облегчить свое состояние алкоголем и наркотиками, что только усложняет клиническую картину и ведет к дальнейшей социальной дезадаптации.
Под влиянием приказных «голосов» и на фоне бредовых переживаний возрастает риск общественно-опасных действий больных. Например, известны случаи нападения на мнимых «преследователей». Но гораздо чаще больные с эндогенной психической патологией совершают ООД по другим механизмам, в том числе при влиянии на их поведение алкогольной или наркотической интоксикации, которая накладывается на негативные симптомы.
Шизофрения — это самое частое заболевание среди пациентов в ПКБ №5 г. Москвы.
Часто встречающийся диагноз: «Шизофрения параноидная, эпизодический тип течения с нарастающим дефектом, неполная ремиссия». Клиническая картина при таком диагнозе включает бред и галлюцинации (обычно — бред преследования и вербальные галлюцинации — «голоса»).
Лечение шизофрении включает нейролептики, антидепрессанты, ноотропы. Ведущая роль принадлежит нейролептикам, действие которых направлено, прежде всего на борьбу с бредом и галлюцинациями. На фоне лечения сначала, как правило, притупляется аффективная реакция больного на свои же переживания, — он становится спокойнее, проходит психомоторное возбуждение. Затем уменьшаются по интенсивности или совсем уходят галлюцинации. Все эти положительные сдвиги становятся заметными уже в первые дни применения нейролептиков. Но фабула (то есть, сюжет) бреда может задержаться надолго, хотя в картине внутренних переживаний она значительно блекнет по актуальности. После купирования острой симптоматики на первый план выходит задача: как уменьшить негативную симптоматику и устранить психопатоподобные (то есть — как при психопатиях) нарушения поведения. В этом помогают нейролептики последних поколений, такие как оланзапин, палиперидон, рисперидон. Уже на этом этапе стоит думать о реабилитации пациента. Вопреки бытовавшему ранее мнению, психотерапия этим больным показана, и она помогает укреплению ремиссии и ресоциализации. Хорошим прогностическим признаком является участие больного в физическом труде, который, сам по себе, приносит значительный лечебный эффект.
После купирования острой симптоматики на первый план выходит задача: как уменьшить негативную симптоматику и устранить психопатоподобные (то есть — как при психопатиях) нарушения поведения. В этом помогают нейролептики последних поколений, такие как оланзапин, палиперидон, рисперидон. Уже на этом этапе стоит думать о реабилитации пациента. Вопреки бытовавшему ранее мнению, психотерапия этим больным показана, и она помогает укреплению ремиссии и ресоциализации. Хорошим прогностическим признаком является участие больного в физическом труде, который, сам по себе, приносит значительный лечебный эффект.
Хотя шизофрения — очень грозное заболевание, но это — не приговор. Ввиду частичной сохранности отдельных способностей (особенно интеллектуальных) и нестандартности мышления у многих таких больных имеется значительный творческий потенциал, что видно, в том числе, по работам, представляемым на фестиваль искусств «Нить Ариадны».
Государственное бюджетное учреждение здравоохранения “Психиатрическая клиническая больница № 13 Департамента здравоохранения города Москвы”
ГБУЗ «ПКБ № 13 ДЗМ» функционирует с 1963г. В больнице работает 6 докторов медицинских наук, 19 кандидата мед. наук, 2 кандидата психологических наук, 73 врача с категориями, из них 52 с высшей категорией, 180 медицинских сестер с различной квалификационной категорией, из них 157 с высшей квалификационной категорией. Получили статус «Московский врач» — 13 врачей-психиатров.
Медицинская помощь оказывается в рамках программы государственной гарантии бесплатного оказания граждан медицинской помощи.
10 ноября 2012 года к стационару присоединились психоневрологические диспансеры №11, №12, №20. Они стали филиалами ПКБ №13. В это же время произошло сокращение коечного фонда (с 850 коек до 720 коек) и их перепрофилирование. Сейчас амбулаторное звено состоит из трех филиалов. В 2017-2018 г. открыты два амбулаторно-диспансерных отделения при филиале №1 и филиале №3, они обслуживают населения районов Люблино, Марьино, Капотню, Некрасовку, Выхино-Жулебино в количестве более 600 тыс. человек. Филиалы, помимо своей основной работы, в качестве платных предоставляют услуги медицинского (психиатрического) освидетельствования для совершения сделок с недвижимостью, на право пользования оружием, управления транспортными средствами и пр.
В больнице работает 6 докторов медицинских наук, 19 кандидата мед. наук, 2 кандидата психологических наук, 73 врача с категориями, из них 52 с высшей категорией, 180 медицинских сестер с различной квалификационной категорией, из них 157 с высшей квалификационной категорией. Получили статус «Московский врач» — 13 врачей-психиатров.
Медицинская помощь оказывается в рамках программы государственной гарантии бесплатного оказания граждан медицинской помощи.
10 ноября 2012 года к стационару присоединились психоневрологические диспансеры №11, №12, №20. Они стали филиалами ПКБ №13. В это же время произошло сокращение коечного фонда (с 850 коек до 720 коек) и их перепрофилирование. Сейчас амбулаторное звено состоит из трех филиалов. В 2017-2018 г. открыты два амбулаторно-диспансерных отделения при филиале №1 и филиале №3, они обслуживают населения районов Люблино, Марьино, Капотню, Некрасовку, Выхино-Жулебино в количестве более 600 тыс. человек. Филиалы, помимо своей основной работы, в качестве платных предоставляют услуги медицинского (психиатрического) освидетельствования для совершения сделок с недвижимостью, на право пользования оружием, управления транспортными средствами и пр. В 2018 году открыты отделения интенсивного оказания психиатрической помощи в диспансерах, кабинеты врача-психиатра “Служба единое окно” при поликлиниках, медико-реабилитационные отделения диспансерного отделения. В филиалах ГБУЗ «ПКБ №13 ДЗМ» есть кабинеты по медицинскому обслуживанию детей и подростков, кабинеты активного диспансерного наблюдения и проведения амбулаторного принудительного лечения. В марте 2018 г. в ГБУЗ «ПКБ№13 ДЗМ» открыто отделение амбулаторной судебно-психиатрической экспертизы. Работа АСПЭ оказывает существенную помощь судебно-следственным органам столицы. С апреля 2019 г. ГБУЗ «Психиатрическая больница №13» ДЗМ на основании приказа Департамента Здравоохранения города Москвы от 13.04.2019 года № 172 переименовано в Государственное бюджетное учреждение здравоохранения «Психиатрическая клиническая больница №13» Департамента Здравоохранения города Москвы, сокращенное наименование ГБУЗ «ПКБ №13 ДЗМ». Для пациентов дневных стационаров регулярно, в рамках программы реабилитации, проводятся: экскурсии, прогулки, литературные встречи, музыкальные концерты, психотерапевтические занятия с пациентами и их родственниками, что способствует социализации пациентов.
В 2018 году открыты отделения интенсивного оказания психиатрической помощи в диспансерах, кабинеты врача-психиатра “Служба единое окно” при поликлиниках, медико-реабилитационные отделения диспансерного отделения. В филиалах ГБУЗ «ПКБ №13 ДЗМ» есть кабинеты по медицинскому обслуживанию детей и подростков, кабинеты активного диспансерного наблюдения и проведения амбулаторного принудительного лечения. В марте 2018 г. в ГБУЗ «ПКБ№13 ДЗМ» открыто отделение амбулаторной судебно-психиатрической экспертизы. Работа АСПЭ оказывает существенную помощь судебно-следственным органам столицы. С апреля 2019 г. ГБУЗ «Психиатрическая больница №13» ДЗМ на основании приказа Департамента Здравоохранения города Москвы от 13.04.2019 года № 172 переименовано в Государственное бюджетное учреждение здравоохранения «Психиатрическая клиническая больница №13» Департамента Здравоохранения города Москвы, сокращенное наименование ГБУЗ «ПКБ №13 ДЗМ». Для пациентов дневных стационаров регулярно, в рамках программы реабилитации, проводятся: экскурсии, прогулки, литературные встречи, музыкальные концерты, психотерапевтические занятия с пациентами и их родственниками, что способствует социализации пациентов. Для воздействия на психоэмоциональное состояние пациентов, его гармонизацию, проводится терапия изобразительным творчеством (арт-терапия), кинезиотерапия, вокалотерапия. а так же производится работа с проблемами и неврозами пациентов через процедуры телесного контакта (телесно-ориентированная терапия). Для населения города Москвы специалистами больницы ежемесячно проводятся психообразовательные лекции, практические семинары и тренинги. Ежегодно на базе всех отделений и филиалов больницы проходят обучение, повышение квалификации и профессиональную переподготовку врачи и ординаторы по специальностям “Психиатрия”, “Психотерапия”, “Психиатрия-наркология”, а также средний медицинский персонал по специальности “Сестринское дело” (в психиатрии и наркологии). Наиболее квалифицированные специалисты больницы делятся своим опытом с коллегами и начинающими врачами. Врачи, завершившие обучение наиболее успешно, трудоустраиваются в больнице. 12.11.2019 ГБУЗ “ПКБ №13 ДЗМ ” стала клинической базой для кафедры “Психиатрии, судебной психиатрии и психосоциальной реабилитации” при Факультете непрерывного медицинского образования Медицинского института Российского университета дружбы народов.
Для воздействия на психоэмоциональное состояние пациентов, его гармонизацию, проводится терапия изобразительным творчеством (арт-терапия), кинезиотерапия, вокалотерапия. а так же производится работа с проблемами и неврозами пациентов через процедуры телесного контакта (телесно-ориентированная терапия). Для населения города Москвы специалистами больницы ежемесячно проводятся психообразовательные лекции, практические семинары и тренинги. Ежегодно на базе всех отделений и филиалов больницы проходят обучение, повышение квалификации и профессиональную переподготовку врачи и ординаторы по специальностям “Психиатрия”, “Психотерапия”, “Психиатрия-наркология”, а также средний медицинский персонал по специальности “Сестринское дело” (в психиатрии и наркологии). Наиболее квалифицированные специалисты больницы делятся своим опытом с коллегами и начинающими врачами. Врачи, завершившие обучение наиболее успешно, трудоустраиваются в больнице. 12.11.2019 ГБУЗ “ПКБ №13 ДЗМ ” стала клинической базой для кафедры “Психиатрии, судебной психиатрии и психосоциальной реабилитации” при Факультете непрерывного медицинского образования Медицинского института Российского университета дружбы народов. Данная кафедра подготавливает врачей судебных психиатров для работы в отделениях судебно-психиатрической экспертизы (амбулаторной и стационарной) в городе Москве и Российской Федерации, специалистов в области психосоциальной реабилитации для работы в медицинских реабилитационных центрах, дневных психиатрических стационарах.
Данная кафедра подготавливает врачей судебных психиатров для работы в отделениях судебно-психиатрической экспертизы (амбулаторной и стационарной) в городе Москве и Российской Федерации, специалистов в области психосоциальной реабилитации для работы в медицинских реабилитационных центрах, дневных психиатрических стационарах.
Психиатрическая клиническая больница № 1 им. Н.А. Алексеева
Заместитель главного врача по медицинской части:
Бурма Александра Алексеевна, тел. (495) 958-50-35
Заместитель главного врача по медицинской части:
Савельев Дмитрий Вадимович, тел. (495) 958-25-19
Заместитель главного врача по судебно-психиатрической экспертизе:
Берсенева Юлия Александровна, тел. (495) 952-88-09
Заместитель главного врача по клинико-экспертной работе:
Строкина Татьяна Владимировна, тел. (495) 954-74-82
Заместитель главного врача по медицинской части:
Целищев Дмитрий Вениаминович, тел. (495) 952-87-59
(495) 952-87-59
Заместитель главного врача по экономическим вопросам:
Лутчев Александр Дмитриевич, тел. (495) 958-21-50
Начальник отдела кадров:
Стеблин Дмитрий Сергеевич, тел. (495)
952-88-60
Главная медицинская сестра:
Чурикова Ирина Евгеньевна, тел. (495) 952-90-79
Главный бухгалтер:
Иванова Ольга Константиновна, тел. (495) 958-56-85
График приема посетителей:
Главный врач
Костюк Георгий Петрович — понедельник с 16 до 18 часов
Заместитель главного врача по медицинской части
Бурма Александра Алексеевна — понедельник с 16 до 18 часов
Заместитель главного врача по медицинской части
Савельев Дмитрий Вадимович — понедельник с 16 до 18 часов
Заместитель главного врача по клинико-экспертной работе
Строкина Татьяна Владимировна — понедельник, среда с 16 до 18 часов
Заместитель главного врача по медицинской части
Целищев Дмитрий Вениаминович — четверг с 16 до 18 часов
Заместитель главного врача по судебно-психиатрической экспертизе
Берсенева Юлия Александровна — понедельник с 15 до 17 часов
Заместитель главного врача по санитарно-эпидемиологическим вопросам
Заведующие психиатрическими отделениями — понедельник с 16 до 18 часов
Лечащие врачи — вторник, четверг с 15 до 17 часов
Дежурные врачи, лечащие врачи — суббота с 10 до 13 часов
За одно посещение разрешено не более 2 посетителей к одному пациенту, запрещается посещение пациентов детьми в возрасте до 14 лет.
По специальному приказу учреждения (например, карантин по гриппу и ОРВИ) посещения могут быть прекращены.
PKB
На протяжении более 50 лет, PKB разрабатывает, производит и продает оборудование для упаковки жидких продуктов и полу-жидкостей. Признанный специалист в области упаковки этих товаров, PKB сейчас является ведущим производителем во Франции машин для парфюмерии, косметики и контрактного производства. В настоящее время на 5 континентах было продано более 10 000 машин и дополнительного оборудования компании PKB. Наши технические разработки позволяют нам находиться на вершине по сравнению с другими производителями в области наполнения и укупорки.
PKB является ведущим производителем линий и машин для розлива парфюмерных и косметических флаконов во Франции , ведущим поставщиком для французской промышленности и в мире.
PKB экспортирует 70% своих машин на 5 континентов различным мелким, средним и крупным промышленным игрокам, а также контрактным производителям.

За последние 70 лет PKB продала более 12 000 машин по всему миру. 80% французского парка упаковочных машин для парфюмерии принадлежит бренду PKB.
Стратегия PKB — это специальная стратегия, ориентированная ТОЛЬКО на рынки парфюмерии и косметики, предлагающая все решения, от самых маленьких машин до самых быстрых (200/400 шт/мин) с навязчивой идеей, присущей ее рынку: МУЛЬТИФОРМАТНОСТЬ, ГИБКОСТЬ, РЕКОРДНО КОРОТКОЕ ВРЕМЯ СМЕНЫ ФОРМАТА, и в конечном счете лучшее соотношение цена/качество на рынке.
У PKB есть только одно стремление: быть мировым лидером в производстве упаковочных машин для косметики и парфюмерии.
PKB обновил 100% своего ассортимента оборудования и теперь держит самый технологичный ассортимент на рынке, на несколько шагов опережая своих конкурентов.
Наполняющие линии
PKB для косметических, туалетных и ароматических средствEKOМашина для наполнения и укупорки флаконов.
 Скорость до 40 шт/мин
Скорость до 40 шт/миндухи, пеномойка, жидкая косметика, косметические кремы
LINOНовая инновационная линейная машина от PKB. Скорость 60-120шт/мин
духи, пеномойка, жидкая косметика
ПКБ: Долг агросектора перед государством может достигать 90% от общей суммы полученных кредитов
Совокупный ссудный портфель предприятий сельско-хозяйственной отрасли перед организациями с государственным участием (в том числе кредитными товариществами) составил около 850 млрд тенге, а это более чем 65% от общего объёма задолженности, сообщает пресс-служба Первого кредитного бюро.
Лишь в нескольких регионах заметными игроками на рынке кредитования являются банки, но и в их портфеле, по данным ПКБ, нет однозначной информации о доле рыночного и государственного финансирования.
«Таким образом, доля государства в общем объёме задолженности может составить и до 90%», – считают аналитики.
Читайте также: Токаев: Мы должны перейти практически полностью на самообеспечение сельхозпродукцией
Сколько выдано субсидий и кредитов. Сегодня в Казахстане на 1 тенге субсидий в сельском хозяйстве приходится 4 тенге кредитных средств. Субсидии также призваны помочь решить и главные «технические и технологические» проблемы сельского хозяйства, к которым относятся слабая ирригация (особенно на севере Казахстана) и высокий средний возраст сельхозтехники. В целом общий предполагаемый размер субсидий на семена, удобрения и пестициды составит не менее 60 млрд тенге. И это только по заявкам, поданным и/или одобренным в первой половине 2021 года в системе Qoldau.
Эти же предприятия за это же время получили кредитов на 305,6 млрд тенге. Ещё 84,3 млрд тенге – это бюджет субсидий на поддержку животноводства в 2021 году, из которых 57,2 млрд тенге было выплачено уже на начало августа.
«Плохие» кредиты. Кредитование предприятий и индивидуальных предпринимателей, занятых в сфере сельского хозяйства, растёт. По состоянию на 1 августа 2021 года ссудный портфель превысил 1,3 трлн тенге, увеличившись за год на 17,4%. Рост портфеля отмечается практически во всех регионах республики. Единственное исключение – это Костанайская область, но и тут сокращение произошло только из-за списания старых неработающих, крупных банковских займов.
Доля кредитов с просрочкой платежей в 90 и более дней за год снизилась с 27,3% до 14,7%.
«Сейчас качество кредитного портфеля находится на лучшем уровне, по крайней мере за последние 2,5 года, при этом в целом ситуация продолжается улучшаться. Улучшение качества происходит в том числе и технически, на фоне банковских списаний и роста общего ссудного портфеля. Но и с этим учётом доля просрочки в сельском хозяйстве выше, чем в среднем по рынку», – отмечают в ПКБ.
Направление кредитования в целом остаётся достаточно рискованным: просрочки допускаются по каждому пятому займу, а доля неработающих кредитов составляет 14,6%.
Разница между pKa и pKb
Автор: Мадху
Ключевое отличие — pKa vs pKbpKa и pKb — общие термины в химии, известные как константы диссоциации. pKa — это константа диссоциации кислоты , а pKb — константа диссоциации оснований . Эти термины используются для упрощения работы с очень большими или очень маленькими значениями. Буква «p» в этих терминах означает «отрицательный логарифм».Ключевое различие между pKa и pKb состоит в том, что pKa — это отрицательный логарифм Ka, тогда как pKb — отрицательный логарифм Kb.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое pKa
3. Что такое pKb
4. Взаимосвязь между pKa и pKb
5. Параллельное сравнение — pKa и pKb в табличной форме
6. Резюме
Что такое pKa?
pKa — отрицательный логарифм Ka. Ka — константа кислотной диссоциации раствора.Это количественное измерение силы кислоты в растворе. Кислоты — это химические соединения, которые могут выделять один или несколько ионов водорода (протонов) в раствор. Если константа диссоциации кислоты; Ka выше, это означает, что кислота полностью (или почти полностью) диссоциирует на ионы, образуя ионы водорода. Затем это указывает на то, что кислота является сильной кислотой. Поскольку pKa является отрицательным логарифмическим значением Ka, pKa является меньшим значением для сильной кислоты.
Ka — константа кислотной диссоциации раствора.Это количественное измерение силы кислоты в растворе. Кислоты — это химические соединения, которые могут выделять один или несколько ионов водорода (протонов) в раствор. Если константа диссоциации кислоты; Ka выше, это означает, что кислота полностью (или почти полностью) диссоциирует на ионы, образуя ионы водорода. Затем это указывает на то, что кислота является сильной кислотой. Поскольку pKa является отрицательным логарифмическим значением Ka, pKa является меньшим значением для сильной кислоты.
pKa = -log 10 K a
Чем ниже pKa vlaue, тем сильнее кислота.Аналогично, чем выше значение pKa, тем слабее кислота. Посмотрев на значения pKa различных кислот, можно сравнить относительную силу кислот. Вместо использования значений Ka обычно используются значения pKa, поскольку это упрощает работу с очень большими или очень маленькими числами с маленькими десятичными знаками.
Рисунок 01: Значения pKa фенола и нитрофенола: нитрофенол является более сильной кислотой, чем фенол, из-за его меньшего значения pKa по сравнению с нитрофенолом.
Помимо сравнения силы кислоты, значения pKa также используются для выбора подходящих буферов.Согласно уравнению Хендерсона-Хассельбаха существует взаимосвязь между pH и pKa системы.
pH = pK a + log 10 ([A — ] / [AH])
для диссоциации кислоты ГК. Это уравнение можно переписать, как показано ниже.
K a / [H + ] = [A –] / [AH]
Согласно этому уравнению, значения pKa и pH одной и той же системы равны, когда половина кислоты диссоциирована.Поскольку буферная способность системы — это ее способность поддерживать pH раствора, следует выбирать буфер, в котором pKa и pH очень близки друг к другу.
Что такое pKb?
pKb — отрицательный логарифм Kb. Kb — константа диссоциации оснований. Он используется для количественного определения прочности основания. Когда основание растворяется в воде, оно распадается на ионы, образуя основной раствор. Сильные основания полностью диссоциируют. Слабые основания частично диссоциируют.
Сильные основания полностью диссоциируют. Слабые основания частично диссоциируют.
pKb = -log 10 K b
Буква p в pKb означает «отрицательный логарифм». Поскольку большинство значений Kb очень большие или очень маленькие, для упрощения работы используются отрицательные логарифмы этих значений. Следовательно, большое значение Kb можно охарактеризовать небольшим значением pKb с маленькими десятичными знаками.
Какая связь между pKa и pKb?
Соотношение между Ka и Kb показано ниже.
кВт = Ka.Кб
Тогда отношение между pKa и pKb определяется как (при 25 o C)
пКа + пКб = 14
В чем разница между pKa и pKb?
pKa и pKb | |
| pKa — отрицательный логарифм Ka. | pKb — отрицательный логарифм Kb. |
| Природа | |
pKa дано для кислот. | Для баз отводитсяпКб. |
| Связь с константой диссоциации | |
| pKa связано с константой диссоциации кислоты. | pKb связано с константой диссоциации оснований. |
| Показания | |
| Чем меньше значение pKa, тем сильнее кислота. | Чем меньше значение pKb, тем слабее база. |
Сводка —
pKa vs pKbpKa и pKb используются для сравнения силы кислот и оснований соответственно.pKa дано для кислотной диссоциации. pKb дано для диссоциации оснований. Разница между pKa и pKb заключается в том, что pKa — это отрицательный логарифм Ka, тогда как pKb — отрицательный логарифм Kb.
Скачать PDF-файл pKa vs pKb
Вы можете загрузить PDF-версию этой статьи и использовать ее в автономных целях в соответствии с примечанием к цитированию. Пожалуйста, скачайте PDF-версию здесь: Разница между pKa и pKb
Ссылка:
1. Helmenstine, Anne Marie, D.«Определение pKa в химии». ThoughtCo, 15 сентября 2017 г. Доступно здесь
Helmenstine, Anne Marie, D.«Определение pKa в химии». ThoughtCo, 15 сентября 2017 г. Доступно здесь
2. Хельменстайн, Энн Мари, Д. «Взаимосвязь pH и pKa: уравнение Хендерсона-Хассельбаха». ThoughtCo, 1 декабря 2017 г. Доступно здесь
3. «Связь между Ka и Kb». Ханская академия. Доступно здесь
Изображение предоставлено:
1.’PKa фенол против нитрофенола. Автор Hbf878 — собственная работа, (общественное достояние) через Commons Wikimedia
AKT / PKB Сигнализация: навигация по сети
Abstract
Ser / Thr киназа AKT, также известная как протеинкиназа B (PKB), была открыта 25 лет назад и была предметом десятков тысяч исследований в различных областях. биологии и медицины.Было много достижений в наших знаниях регулирующих входов восходящего направления в AKT, ключевых многофункциональных нисходящих сигнальных узлах (GSK3, FoxO, mTORC1), которые значительно расширяют функциональный репертуар Akt, а также сложной схемы этой динамически разветвляющейся и зацикленной сигнальной сети. это повсеместно почти в каждой клетке нашего тела. Генетические исследования на мышах и людях также выявили физиологическую роль сети AKT почти в каждой системе органов. Наше понимание регуляции и функций AKT особенно важно с учетом последствий дисфункции AKT в различных патологических условиях, включая синдромы развития и чрезмерного роста, рак, сердечно-сосудистые заболевания, инсулинорезистентность и диабет 2 типа, воспалительные и аутоиммунные расстройства и неврологические расстройства.Также был достигнут значительный прогресс в разработке AKT-селективных низкомолекулярных ингибиторов. Улучшенное понимание молекулярной проводки сигнальной сети AKT продолжает оказывать влияние, которое затрагивает большинство дисциплин биомедицинских наук.
это повсеместно почти в каждой клетке нашего тела. Генетические исследования на мышах и людях также выявили физиологическую роль сети AKT почти в каждой системе органов. Наше понимание регуляции и функций AKT особенно важно с учетом последствий дисфункции AKT в различных патологических условиях, включая синдромы развития и чрезмерного роста, рак, сердечно-сосудистые заболевания, инсулинорезистентность и диабет 2 типа, воспалительные и аутоиммунные расстройства и неврологические расстройства.Также был достигнут значительный прогресс в разработке AKT-селективных низкомолекулярных ингибиторов. Улучшенное понимание молекулярной проводки сигнальной сети AKT продолжает оказывать влияние, которое затрагивает большинство дисциплин биомедицинских наук.
25 лет передачи сигналов AKT
Тридцать лет назад Стивен Стаал идентифицировал и клонировал онкоген v-Akt из трансформирующего ретровируса AKT8 (Staal, 1987). Четыре года спустя три лаборатории независимо клонировали и охарактеризовали клеточный гомолог v-AKT, протеинкиназу 57 Kd Ser / Thr. Bellacosa и Tsichlis использовали гибридизацию кДНК с v-AKT для клонирования протеинкиназы и назвали ее c-AKT (Bellacosa et al., 1991). Группа Хеммингса использовала вырожденную ПЦР для последовательностей, кодирующих каталитические домены протеинкиназы, чтобы идентифицировать киназу, которую они назвали родственной A- и C-киназе (RAC) (Jones et al., 1991). Вудгетт и Коффер использовали скрининг библиотеки и идентифицировали протеинкиназу, которую они назвали протеинкиназой B (PKB) из-за сходства с PKA и PKC (Coffer and Woodgett, 1991).Теперь мы знаем, что существуют три изоформы AKT / PKB, консервативные в геномах млекопитающих: AKT1 (PKBα), AKT2 (PKBβ) и AKT3 (PKBγ). AKT оказался в центре внимания трансдукции сигналов несколько лет спустя, когда было обнаружено, что активация AKT происходит ниже фосфоинозитид-3-киназы (PI3K), липидкиназы, связанной с клеточной трансформацией и инсулиновым ответом (Cantley, 2004).
Bellacosa и Tsichlis использовали гибридизацию кДНК с v-AKT для клонирования протеинкиназы и назвали ее c-AKT (Bellacosa et al., 1991). Группа Хеммингса использовала вырожденную ПЦР для последовательностей, кодирующих каталитические домены протеинкиназы, чтобы идентифицировать киназу, которую они назвали родственной A- и C-киназе (RAC) (Jones et al., 1991). Вудгетт и Коффер использовали скрининг библиотеки и идентифицировали протеинкиназу, которую они назвали протеинкиназой B (PKB) из-за сходства с PKA и PKC (Coffer and Woodgett, 1991).Теперь мы знаем, что существуют три изоформы AKT / PKB, консервативные в геномах млекопитающих: AKT1 (PKBα), AKT2 (PKBβ) и AKT3 (PKBγ). AKT оказался в центре внимания трансдукции сигналов несколько лет спустя, когда было обнаружено, что активация AKT происходит ниже фосфоинозитид-3-киназы (PI3K), липидкиназы, связанной с клеточной трансформацией и инсулиновым ответом (Cantley, 2004).
PI3K класса I фосфорилирует 3′-гидроксил головной группы инозита фосфоинозитидов, в результате чего образуются вторичные мессенджеры липидов PtdIns-3,4-P 2 (PI3,4P 2 ) и PtdIns-3, 4,5-П 3 (ПИП 3 ). Однако нижестоящие эффекторы продуктов PI3K в середине 90-х были неизвестны. Franke, Kaplan и Tsichlis, работающие с мутантами рецептора PDGF, разработанными Казлаускасом, показали, что стимуляция клеток PDGF приводит к активации AKT способом, который зависит исключительно от способности PI3K связываться с рецептором PDGF (Franke et al., 1995 ). Burgering and Coffer (Burgering and Coffer, 1995), а также лаборатория Roth (Kohn et al., 1995) использовали аналогичные подходы, чтобы показать, что AKT активируется факторами роста PI3K-зависимым образом.AKT прочно утвердился как первый полноценный эффектор PI3K в клетках. Остается выяснить точный механизм, с помощью которого PI3K и его липидные продукты активируют AKT. AKT обладает доменом Pleckstrin Homology (PH) на своем амино-конце, который, как первоначально показали Доунс и Алесси, может связываться с PIP 3 (James et al., 1996). Впоследствии было показано, что как PI3,4P 2 , так и PIP 3 непосредственно связываются с доменом PH AKT, а связывание PI3,4P 2 индуцирует частичную активацию протеинкиназы in vitro (Franke и другие.
Однако нижестоящие эффекторы продуктов PI3K в середине 90-х были неизвестны. Franke, Kaplan и Tsichlis, работающие с мутантами рецептора PDGF, разработанными Казлаускасом, показали, что стимуляция клеток PDGF приводит к активации AKT способом, который зависит исключительно от способности PI3K связываться с рецептором PDGF (Franke et al., 1995 ). Burgering and Coffer (Burgering and Coffer, 1995), а также лаборатория Roth (Kohn et al., 1995) использовали аналогичные подходы, чтобы показать, что AKT активируется факторами роста PI3K-зависимым образом.AKT прочно утвердился как первый полноценный эффектор PI3K в клетках. Остается выяснить точный механизм, с помощью которого PI3K и его липидные продукты активируют AKT. AKT обладает доменом Pleckstrin Homology (PH) на своем амино-конце, который, как первоначально показали Доунс и Алесси, может связываться с PIP 3 (James et al., 1996). Впоследствии было показано, что как PI3,4P 2 , так и PIP 3 непосредственно связываются с доменом PH AKT, а связывание PI3,4P 2 индуцирует частичную активацию протеинкиназы in vitro (Franke и другие. , 1997; Frech et al., 1997; Клиппель и др., 1997).
, 1997; Frech et al., 1997; Клиппель и др., 1997).
Другими важными открытиями в этой области были механизмы прекращения активности AKT и его первых субстратов. Активности PI3K противодействует опухолевый супрессор PTEN, впервые клонированный лабораториями Parsons и Steck (Li et al., 1997; Steck et al., 1997), и охарактеризованный Диксоном как фосфатаза PIP 3 (Maehama and Dixon, 1998). Одновременно с идентификацией AKT как эффектора PI3K была проделана большая работа по раскрытию роли PI3K в передаче сигналов инсулина, что привело к открытию того, что GSK-3β является субстратом AKT в инсулино-стимулированных клетках (Cross et al., 1995). Идентификация этого первого субстрата AKT также сыграла важную роль в последующих исследованиях для определения оптимального консенсусного мотива фосфорилирования AKT (Alessi et al., 1996b), который с тех пор способствовал открытию более сотни субстратов AKT, связанных с физиологией клетки и заболеванием.
За последние 25 лет в области передачи сигналов Akt произошли заметные расширения и открытия, которые имеют центральное значение для здоровья и болезней человека. Здесь мы предоставляем обновление и дополнение к обзору 2007 года (Manning and Cantley, 2007), который обеспечивает более сетевой взгляд на передачу сигналов Akt.Мы выделяем подробные механизмы, которые учитывают регуляцию AKT, ключевые нижестоящие ветви, регулируемые AKT, как сеть AKT связана и интегрируется с другими клеточными сигналами, как это, в свою очередь, влияет на физиологию и патобиологию AKT и, наконец, как терапевтическое нацеливание на Сеть AKT может использоваться для лечения болезней человека.
Здесь мы предоставляем обновление и дополнение к обзору 2007 года (Manning and Cantley, 2007), который обеспечивает более сетевой взгляд на передачу сигналов Akt.Мы выделяем подробные механизмы, которые учитывают регуляцию AKT, ключевые нижестоящие ветви, регулируемые AKT, как сеть AKT связана и интегрируется с другими клеточными сигналами, как это, в свою очередь, влияет на физиологию и патобиологию AKT и, наконец, как терапевтическое нацеливание на Сеть AKT может использоваться для лечения болезней человека.
Восходящая регуляция AKT
PI3K-зависимая активация AKT
Активация PI3K внеклеточными стимулами приводит к активации AKT практически во всех клетках и тканях.Таким образом, PI3K и его липидные продукты обычно считаются облигатными и ограничивающими скорость для правильной активации AKT. Канонический путь, ведущий к активации AKT, инициируется стимуляцией рецепторных тирозинкиназ (RTK) или рецепторов, связанных с G-белком (GPCR), что приводит к рекрутированию плазматической мембраны и активации одной или нескольких изоформ семейства PI3K класса I. обзор PI3K, см. (Vanhaesebroeck et al., 2010)). Также важным для регуляции PI3K является взаимодействие с членами семейства малых GTPases Ras (Rodriguez et al., 1994). PI3K класса I преимущественно фосфорилируют PI4, 5P 2 , тем самым производя PIP 3 (Vanhaesebroeck et al., 2010), тогда как обычно следует синтез PI3,4P 2 , возможно, в результате действия 5′-фосфатазы Содержащая домен Sh3 инозитол-5′-фосфатаза (SHIP) на PIP 3 (Franke et al., 1997; Guilherme et al., 1996). PI3,4P 2 также могут быть синтезированы PI3K класса II с использованием PI4P в качестве субстрата (обзор в (Hawkins and Stephens, 2016)).. Хотя конкретная изоформа PI3K, активированная в данном клеточном контексте, может отличаться, конечный результат такой же — перемещение неактивного AKT в мембранные сайты накопления PI3,4P 2 или PIP 3 посредством вовлечения домена AKT PH.
обзор PI3K, см. (Vanhaesebroeck et al., 2010)). Также важным для регуляции PI3K является взаимодействие с членами семейства малых GTPases Ras (Rodriguez et al., 1994). PI3K класса I преимущественно фосфорилируют PI4, 5P 2 , тем самым производя PIP 3 (Vanhaesebroeck et al., 2010), тогда как обычно следует синтез PI3,4P 2 , возможно, в результате действия 5′-фосфатазы Содержащая домен Sh3 инозитол-5′-фосфатаза (SHIP) на PIP 3 (Franke et al., 1997; Guilherme et al., 1996). PI3,4P 2 также могут быть синтезированы PI3K класса II с использованием PI4P в качестве субстрата (обзор в (Hawkins and Stephens, 2016)).. Хотя конкретная изоформа PI3K, активированная в данном клеточном контексте, может отличаться, конечный результат такой же — перемещение неактивного AKT в мембранные сайты накопления PI3,4P 2 или PIP 3 посредством вовлечения домена AKT PH.
A. Стимуляция RTK или GPCR приводит к активации PI3K, что приводит к продукции PIP 3 на плазматической мембране. Цитозольный неактивный AKT рекрутируется на мембрану и вовлекает PIP 3 посредством связывания домена PH.Это приводит к фосфорилированию T308 и S473 PDK1 и mTORC2 соответственно, что приводит к полной активации. Обрыв сигнала достигается фосфатазой PTEN PIP 3 и протеинфосфатазами PP2A и PHLPP. Вероятно, существует отдельный эндомембранный пул активного AKT, который активируется посредством взаимодействия PI3,4P 2 посредством действия SHIP-фосфатазы и прекращается с помощью INPP4B. B. Модульная структура AKT1 с положением PTM, окрашенным цветом для фосфорилирования (pSer / pThr / pTyr), ацетилирования (Lys-Ac), убиквитилирования (Lys-Ub), метилирования (Lys-Me), гидроксилирования (Pro- OH), гликозилирование (O-GlcNac) и SUMOylation (Lys-SUMO).
Стимуляция RTK или GPCR приводит к активации PI3K, что приводит к продукции PIP 3 на плазматической мембране. Цитозольный неактивный AKT рекрутируется на мембрану и вовлекает PIP 3 посредством связывания домена PH.Это приводит к фосфорилированию T308 и S473 PDK1 и mTORC2 соответственно, что приводит к полной активации. Обрыв сигнала достигается фосфатазой PTEN PIP 3 и протеинфосфатазами PP2A и PHLPP. Вероятно, существует отдельный эндомембранный пул активного AKT, который активируется посредством взаимодействия PI3,4P 2 посредством действия SHIP-фосфатазы и прекращается с помощью INPP4B. B. Модульная структура AKT1 с положением PTM, окрашенным цветом для фосфорилирования (pSer / pThr / pTyr), ацетилирования (Lys-Ac), убиквитилирования (Lys-Ub), метилирования (Lys-Me), гидроксилирования (Pro- OH), гликозилирование (O-GlcNac) и SUMOylation (Lys-SUMO).
Прекращение передачи сигналов PI3K / PIP 3 в первую очередь достигается с помощью фосфатазы PTEN, которая дефосфорилирует PIP 3 , превращая его обратно в PI4,5P 2 . Первоначальный синтез липидных продуктов PI3K наблюдается в пределах от секунд до минут после стимуляции фактором роста, имеет пик, как правило, в первый час, а затем снижается со временем, которое зависит от типа клеток и стимула (Auger et al., 1989 ). Преходящий характер этого сигнала в значительной степени достигается действием PTEN в сочетании с временной инактивацией PI3K.Хотя AKT является наиболее широко изученным эффектором передачи сигналов PI3K и влияет на большинство фенотипов, связанных с активацией пути PI3K, стоит отметить, что существует множество других нижестоящих эффекторов PI3K, которые активируются параллельно с Akt и вносят вклад в последующий клеточный ответ ( Vanhaesebroeck et al., 2010).
Первоначальный синтез липидных продуктов PI3K наблюдается в пределах от секунд до минут после стимуляции фактором роста, имеет пик, как правило, в первый час, а затем снижается со временем, которое зависит от типа клеток и стимула (Auger et al., 1989 ). Преходящий характер этого сигнала в значительной степени достигается действием PTEN в сочетании с временной инактивацией PI3K.Хотя AKT является наиболее широко изученным эффектором передачи сигналов PI3K и влияет на большинство фенотипов, связанных с активацией пути PI3K, стоит отметить, что существует множество других нижестоящих эффекторов PI3K, которые активируются параллельно с Akt и вносят вклад в последующий клеточный ответ ( Vanhaesebroeck et al., 2010).
Основные события регулирующего фосфорилирования на Akt
Активация PI3K приводит к фосфорилированию двух ключевых остатков на AKT1, T308 в активации, или Т-петле, ядра каталитической протеинкиназы и S473 в C-концевом гидрофобном мотиве (Алесси и др., 1996а) (). Фосфорилирование обоих остатков необходимо для максимальной активации киназы. Регулирование также происходит по соответствующим остаткам в AKT2 (T309 и S474) и AKT3 (T305 и S472). Фосфоинозитид-зависимая протеинкиназа 1 (PDK1) была обнаружена благодаря ее способности фосфорилировать AKT1 по T308, который необходим для активности AKT (Alessi et al., 1997; Stokoe et al., 1997). Перемещение как AKT, так и PDK1 к участкам мембраны синтеза PIP 3 или PI3,4P 2 вызывает конформационные изменения, обеспечивающие доступ PDK1 к AKT для фосфорилирования T308.В неактивной конформации PH-домен AKT является ингибирующим, и эта конформация «PH-in» устраняется вовлечением PH-домена продуктов PI3K, что приводит к конформации «PH-out», которая высвобождает киназный домен и делает возможным его фосфорилирование с помощью PDK1. (Calleja et al., 2007; Calleja et al., 2009). PDK1 также необходим для фосфорилирования петли активации других протеинкиназ семейства AGC (относящихся к протеинкиназам A, G и C), включая все изоформы киназ PKC, S6K, SGK и RSK, стимулированных фактором роста (Mora и другие.
Регулирование также происходит по соответствующим остаткам в AKT2 (T309 и S474) и AKT3 (T305 и S472). Фосфоинозитид-зависимая протеинкиназа 1 (PDK1) была обнаружена благодаря ее способности фосфорилировать AKT1 по T308, который необходим для активности AKT (Alessi et al., 1997; Stokoe et al., 1997). Перемещение как AKT, так и PDK1 к участкам мембраны синтеза PIP 3 или PI3,4P 2 вызывает конформационные изменения, обеспечивающие доступ PDK1 к AKT для фосфорилирования T308.В неактивной конформации PH-домен AKT является ингибирующим, и эта конформация «PH-in» устраняется вовлечением PH-домена продуктов PI3K, что приводит к конформации «PH-out», которая высвобождает киназный домен и делает возможным его фосфорилирование с помощью PDK1. (Calleja et al., 2007; Calleja et al., 2009). PDK1 также необходим для фосфорилирования петли активации других протеинкиназ семейства AGC (относящихся к протеинкиназам A, G и C), включая все изоформы киназ PKC, S6K, SGK и RSK, стимулированных фактором роста (Mora и другие. , 2004). Однако ни одна из этих киназ не обладает доменом связывания PIP 3 , и AKT, по-видимому, является единственной облигатной PIP 3 -зависимой мишенью PDK1 среди этой группы (Collins et al., 2003; McManus et al., 2004) .
, 2004). Однако ни одна из этих киназ не обладает доменом связывания PIP 3 , и AKT, по-видимому, является единственной облигатной PIP 3 -зависимой мишенью PDK1 среди этой группы (Collins et al., 2003; McManus et al., 2004) .
Максимальная активация AKT требует фосфорилирования S473 в гидрофобном мотиве. Первичная киназа AKT S473 является механистической мишенью комплекса рапамциина (mTOR) 2 (mTORC2) (Sarbassov et al., 2005) (). Хотя AKT, лишенный фосфорилирования S473, обладает активностью, она значительно снижена, а фосфорилирование S473 стабилизирует T308. фосфорилирование и состояние активации AKT (Alessi et al., 1996a; Ян и др., 2002). По аналогии с PDK1, mTORC2 также фосфорилирует другие киназы AGC по их соответствующим остаткам гидрофобного мотива, хотя соответствующий мотив в S6K1 (T389) нацелен на mTORC1 (Saxton and Sabatini, 2017). Также как и PDK1, некоторые мишени mTORC2 фосфорилируются конститутивно (например, PKC), тогда как другие фосфорилируются только в ответ на передачу сигналов PI3K (например, AKT, SGK). Активность протеинкиназы mTORC2, определенная при иммуноочистке, стимулируется факторами роста PI3K-зависимым образом (Huang et al., 2008; Сарбасов и др., 2005). Недавнее исследование предложило механизм этой регуляции, указав, что домен PH в компоненте SIN1 mTORC2 служит для связывания с PIP 3 , что приводит к облегчению аутоингибирования активности киназы mTOR в комплексе (Liu et al., 2015) . Связывание PIP 3 , следовательно, будет иметь двойную функцию перемещения mTORC2 на мембраны, где рекрутируется AKT, а также снятия конформационных ограничений на mTOR, позволяющих фосфорилирование AKT.Однако отдельное исследование с использованием внутриклеточных репортеров, специфичных для компартментов, пришло к выводу, что активация PI3K не обязательна для активности mTORC2 на мембранах (Ebner et al., 2017b). В этой модели именно перемещение AKT к специфическим мембранам через его домен PH позволяет mTORC2 получить доступ к S473. Хотя более ранние исследования предполагали, что PIP 3 локализован исключительно на плазматической мембране, в более поздних отчетах представлены доказательства эндомембранных пулов PIP 3 и PI3,4P 2 , которые непосредственно способствуют активации AKT (Jethwa et al.
Активность протеинкиназы mTORC2, определенная при иммуноочистке, стимулируется факторами роста PI3K-зависимым образом (Huang et al., 2008; Сарбасов и др., 2005). Недавнее исследование предложило механизм этой регуляции, указав, что домен PH в компоненте SIN1 mTORC2 служит для связывания с PIP 3 , что приводит к облегчению аутоингибирования активности киназы mTOR в комплексе (Liu et al., 2015) . Связывание PIP 3 , следовательно, будет иметь двойную функцию перемещения mTORC2 на мембраны, где рекрутируется AKT, а также снятия конформационных ограничений на mTOR, позволяющих фосфорилирование AKT.Однако отдельное исследование с использованием внутриклеточных репортеров, специфичных для компартментов, пришло к выводу, что активация PI3K не обязательна для активности mTORC2 на мембранах (Ebner et al., 2017b). В этой модели именно перемещение AKT к специфическим мембранам через его домен PH позволяет mTORC2 получить доступ к S473. Хотя более ранние исследования предполагали, что PIP 3 локализован исключительно на плазматической мембране, в более поздних отчетах представлены доказательства эндомембранных пулов PIP 3 и PI3,4P 2 , которые непосредственно способствуют активации AKT (Jethwa et al. , 2015) (). Ясно, что молекулярная и пространственная регуляция mTORC2 и ее связь с активацией Akt остается важной и активной областью исследований. Наконец, связанная с mTOR киназа ДНК-зависимая протеинкиназа (DNA-PK) может заменять активность mTORC2 на фосфорилирование AKT S473 в ответ на повреждение ДНК (Bozulic et al., 2008), но пространственная природа этой регуляции имеет не определено.
, 2015) (). Ясно, что молекулярная и пространственная регуляция mTORC2 и ее связь с активацией Akt остается важной и активной областью исследований. Наконец, связанная с mTOR киназа ДНК-зависимая протеинкиназа (DNA-PK) может заменять активность mTORC2 на фосфорилирование AKT S473 в ответ на повреждение ДНК (Bozulic et al., 2008), но пространственная природа этой регуляции имеет не определено.
Время жизни активного, полностью фосфорилированного AKT на плазматической мембране относительно короткое (Calleja et al., 2007; Jethwa et al., 2015). Поскольку фосфорилированный AKT может быть обнаружен внутриклеточно и может фосфорилировать субстраты до двух часов после стимуляции (Kunkel et al., 2005), обычно считается, что AKT может обходиться без связывания PIP 3 после фосфорилирования и в активной конформации. Однако недавнее исследование показало, что связывание PIP 3 аллостерически активирует AKT и что диссоциация от PIP 3 ограничивает скорость дефосфорилирования и инактивации Akt (Ebner et al. , 2017а). В этой провокационной модели AKT-опосредованное фосфорилирование субстрата должно ограничиваться мембранами, содержащими липидные продукты PI3K, а не за счет высвобождения активного AKT в цитозольные компартменты. Однако AKT фосфорилирует множество белковых субстратов с разнообразной субклеточной локализацией (Manning and Cantley, 2007). Некоторые мишени AKT локализуются на поверхности эндомембраны (например, TSC2 (Menon et al., 2014; Roberts et al., 2004)), но другие нет, например, факторы транскрипции, локализованные в ядре (например, TSC2).г., FoxO (Brunet et al., 1999)). Несмотря на это предостережение, эндомембраны содержат PI3,4P 2 , и этот способ регуляции AKT может представлять механизм, с помощью которого PI3,4P 2 и PIP 3 задействуют различные пулы AKT (Braccini et al., 2015) ( ). Эта модель подтверждается исследованиями фосфатазы PI3,4P 2 и опухолевого супрессора INPP4B, потеря которого приводит к повышению уровня PI3,4P 2 в эндосомах и активации AKT2 (Braccini et al.
, 2017а). В этой провокационной модели AKT-опосредованное фосфорилирование субстрата должно ограничиваться мембранами, содержащими липидные продукты PI3K, а не за счет высвобождения активного AKT в цитозольные компартменты. Однако AKT фосфорилирует множество белковых субстратов с разнообразной субклеточной локализацией (Manning and Cantley, 2007). Некоторые мишени AKT локализуются на поверхности эндомембраны (например, TSC2 (Menon et al., 2014; Roberts et al., 2004)), но другие нет, например, факторы транскрипции, локализованные в ядре (например, TSC2).г., FoxO (Brunet et al., 1999)). Несмотря на это предостережение, эндомембраны содержат PI3,4P 2 , и этот способ регуляции AKT может представлять механизм, с помощью которого PI3,4P 2 и PIP 3 задействуют различные пулы AKT (Braccini et al., 2015) ( ). Эта модель подтверждается исследованиями фосфатазы PI3,4P 2 и опухолевого супрессора INPP4B, потеря которого приводит к повышению уровня PI3,4P 2 в эндосомах и активации AKT2 (Braccini et al. , 2015; Fedele et al. al., 2010; Гевиннер и др., 2009; Ли Чу и др., 2015). Ограничение активности AKT мембранами, на которых присутствуют липидные продукты PI3K, может служить для обеспечения специфичности и точности выбора субстрата, а также механизма пространственной сегрегации для конкретных сигнальных событий.
, 2015; Fedele et al. al., 2010; Гевиннер и др., 2009; Ли Чу и др., 2015). Ограничение активности AKT мембранами, на которых присутствуют липидные продукты PI3K, может служить для обеспечения специфичности и точности выбора субстрата, а также механизма пространственной сегрегации для конкретных сигнальных событий.
Хотя множество исследований продемонстрировали обязательную потребность в PI3K для активации AKT, есть сообщения, предполагающие, что активация AKT может происходить независимо от связывания PI3K и, предположительно, фосфоинозитида с AKT.Однако, может ли функциональная активация AKT происходить в отсутствие продуктивной передачи сигналов PI3K, не было твердо установлено, и любой такой механизм должен быть подтвержден четкими доказательствами высвобождения домена PH и воздействия на ядро каталитической киназы.
Другие регуляторные модификации Akt
Хотя фосфорилирование T308 и S473 считается ограничивающим скорость и обязательным для максимальной активации AKT ниже PI3K, были обнаружены многие другие посттрансляционные модификации, которые предположительно служат для точной настройки активации, инактивации AKT, клеточной локализация или, возможно, субстратная специфичность (). Были картированы многочисленные сайты фосфорилирования на AKT, и некоторые из них были связаны с функцией AKT (Guo et al., 2014). T450 в области, называемой поворотным мотивом, конститутивно фосфорилируется mTORC2, происходит ко-трансляционно и необходим для правильного сворачивания возникающего полипептида AKT (Facchinetti et al., 2008; Ikenoue et al., 2008). S477 и T479 в регуляторном домене может фосфорилироваться в зависимости от клеточного цикла комплексом циклин A-CDK2, но также может быть мишенью, наряду с S473, mTORC2 для усиления активности AKT (Liu et al., 2014). CK2 фосфорилирует S129 и увеличивает каталитическую активность (Di Maira et al., 2005), тогда как GSK-3α-опосредованное фосфорилирование T312, по-видимому, ослабляет активность AKT (Gulen et al., 2012). Многие дополнительные сайты фосфорилирования на AKT, включая ряд остатков тирозина, были картированы фосфопротеомикой, но механизмы, которые объясняют эти модификации и их физиологическое значение, неизвестны (обзор в (Risso et al.
Были картированы многочисленные сайты фосфорилирования на AKT, и некоторые из них были связаны с функцией AKT (Guo et al., 2014). T450 в области, называемой поворотным мотивом, конститутивно фосфорилируется mTORC2, происходит ко-трансляционно и необходим для правильного сворачивания возникающего полипептида AKT (Facchinetti et al., 2008; Ikenoue et al., 2008). S477 и T479 в регуляторном домене может фосфорилироваться в зависимости от клеточного цикла комплексом циклин A-CDK2, но также может быть мишенью, наряду с S473, mTORC2 для усиления активности AKT (Liu et al., 2014). CK2 фосфорилирует S129 и увеличивает каталитическую активность (Di Maira et al., 2005), тогда как GSK-3α-опосредованное фосфорилирование T312, по-видимому, ослабляет активность AKT (Gulen et al., 2012). Многие дополнительные сайты фосфорилирования на AKT, включая ряд остатков тирозина, были картированы фосфопротеомикой, но механизмы, которые объясняют эти модификации и их физиологическое значение, неизвестны (обзор в (Risso et al. , 2015), см. Http: / /www.phosphosite.org).
, 2015), см. Http: / /www.phosphosite.org).
Помимо фосфорилирования, были идентифицированы различные другие посттрансляционные модификации изоформ Akt (). Задокументировано ацетилирование K14 в домене AKT PH, и гистоновая деацетилаза SIRT1 деацетилирует этот остаток. K14 ацетилирование, как предполагается, необходимо для связывания AKT с PIP 3 и, следовательно, для транслокации мембран (Sundaresan et al., 2011). Остаток K14 в домене PH, по-видимому, является функционально важным для регуляции, поскольку он модифицируется ацетилированием, убиквитилированием и метилированием, в зависимости от используемых клеточных условий.Сообщалось об окислении остатков Cys в линкерной области AKT2, которое может обеспечивать регуляцию, специфичную для изоформ, поскольку эти остатки не консервативны в AKT1 или AKT3 (Wani et al., 2011). Сообщалось также о гликозилировании AKT на T305 и T312 в каталитическом ядре (Wang et al., 2012). AKT гидроксилируется пролилгидроксилазой EglN1 / PHD2 по ряду остатков Pro, в частности, P125 и P313 , , тем самым запуская взаимодействие с pVHL (Guo et al. , 2016).
, 2016).
AKT убиквитилирован по множеству различных остатков Lys.Что касается деградационного полиубиквитилирования, то множественные E3 ubiquitin-ligases, как было показано, катализируют K48-связанное убиквитилирование AKT, тем самым способствуя протеасомозависимой деградации (rev. (Chan et al., 2014)). Напротив, отдельные убиквитинлигазы, которые связывают K63-связанный убиквитин с AKT, служат для регулирования активации AKT. Например, различные факторы роста вызывают активацию лигаз E3 TRAF6 (Yang et al., 2009), Skp2 (Chan et al., 2012) и NEDD4-1 (Fan et al., 2013), которые нацелены на остатки Lys в AKT. Домен PH, и эти модификации усиливают локализацию мембраны.Прекращение этого сигнала достигается деубиквитинирующими ферментами CYLD (Lim et al., 2012). Наконец, SUMOylation AKT по нескольким остаткам Lys, включая K276, опосредованное SUMO E3 лигазой PIAS, также описано и предположительно участвует в активации AKT (Li et al., 2013).
Прерывание сигнала фосфатазами AKT
Помимо терминации сигнала липидными фосфатазами, такими как PTEN и INPP4B, две критически важные протеинфосфатазы действуют, чтобы напрямую инактивировать AKT (). Протеинфосфатаза 2A (PP2A) дефосфорилирует AKT T308, что приводит к инактивации киназы (Andjelkovic et al., 1996). Регуляторная субъединица PP2A B55α может напрямую связываться с AKT в лимфоидных клетках (Kuo et al., 2008), тогда как субъединица B56β направляет PP2AC на AKT в адипоцитах (Padmanabhan et al., 2009). Богатые лейцином повторяющиеся протеин-фосфатазы PH-домена (PHLPP1 и PHLPP2) были открыты как физиологические фосфатазы AKT S473 (Gao et al., 2005). PHLPP1 и PHLPP2 дефосфорилируют S473 по конкретным изоформам AKT (Brognard et al., 2007). Поскольку потеря активности PHLPP ведет к гиперфосфорилированию AKT, неудивительно, что экспрессия PHLPP1 / 2 снижается или теряется при многих раковых заболеваниях (Chen et al., 2011).
Протеинфосфатаза 2A (PP2A) дефосфорилирует AKT T308, что приводит к инактивации киназы (Andjelkovic et al., 1996). Регуляторная субъединица PP2A B55α может напрямую связываться с AKT в лимфоидных клетках (Kuo et al., 2008), тогда как субъединица B56β направляет PP2AC на AKT в адипоцитах (Padmanabhan et al., 2009). Богатые лейцином повторяющиеся протеин-фосфатазы PH-домена (PHLPP1 и PHLPP2) были открыты как физиологические фосфатазы AKT S473 (Gao et al., 2005). PHLPP1 и PHLPP2 дефосфорилируют S473 по конкретным изоформам AKT (Brognard et al., 2007). Поскольку потеря активности PHLPP ведет к гиперфосфорилированию AKT, неудивительно, что экспрессия PHLPP1 / 2 снижается или теряется при многих раковых заболеваниях (Chen et al., 2011).
Подложки и функции AKT: ключевые сигнальные узлы
В литературе описано более сотни подложек AKT. Хотя не все эти мишени были тщательно подтверждены, как обсуждалось ранее (Manning and Cantley, 2007), коллективные исследования передачи сигналов AKT, проведенные на протяжении многих лет, предполагают широкий спектр нижестоящих эффектов в различных условиях, обусловленных его параллельной регуляцией нескольких субстратов. (примеры в).В зависимости от последовательности, AKT напрямую фосфорилирует белковые мишени различных функциональных классов, включая протеиновые и липидные киназы, факторы транскрипции, регуляторы малых G-белков и транспорта везикул, метаболические ферменты, убиквитинлигазы E3, регуляторы клеточного цикла и многие другие. . AKT фосфорилирует эти мишени по остаткам Ser / Thr в основном в пределах минимального консенсусного мотива распознавания RXRXXS / T-ϕ (где X — любая аминокислота, а ϕ обозначает предпочтение больших гидрофобных остатков), чтобы либо активировать, либо, что более часто, ингибировать функцию. данного белка.Однако простое существование этого мотива, который можно найти в тысячах белков, не делает этот белок подлинным субстратом AKT. Такие факторы, как доступность сайта на субстрате, вторичные взаимодействия с AKT и субклеточная компартментализация, также могут вносить свой вклад. Кроме того, несколько хорошо зарекомендовавших себя субстратов AKT фосфорилируются на модифицированных версиях этого мотива, включая AMP-регулируемую протеинкиназу (AMPK) и АТФ-цитратлиазу (ACLY), оба из которых имеют остаток Pro в положении -5.
(примеры в).В зависимости от последовательности, AKT напрямую фосфорилирует белковые мишени различных функциональных классов, включая протеиновые и липидные киназы, факторы транскрипции, регуляторы малых G-белков и транспорта везикул, метаболические ферменты, убиквитинлигазы E3, регуляторы клеточного цикла и многие другие. . AKT фосфорилирует эти мишени по остаткам Ser / Thr в основном в пределах минимального консенсусного мотива распознавания RXRXXS / T-ϕ (где X — любая аминокислота, а ϕ обозначает предпочтение больших гидрофобных остатков), чтобы либо активировать, либо, что более часто, ингибировать функцию. данного белка.Однако простое существование этого мотива, который можно найти в тысячах белков, не делает этот белок подлинным субстратом AKT. Такие факторы, как доступность сайта на субстрате, вторичные взаимодействия с AKT и субклеточная компартментализация, также могут вносить свой вклад. Кроме того, несколько хорошо зарекомендовавших себя субстратов AKT фосфорилируются на модифицированных версиях этого мотива, включая AMP-регулируемую протеинкиназу (AMPK) и АТФ-цитратлиазу (ACLY), оба из которых имеют остаток Pro в положении -5. , а не канонический остаток Arg (Berwick et al., 2002; Хорман и др., 2006). В настоящее время также признано, что даже наиболее хорошо зарекомендовавшие себя субстраты AKT не регулируются исключительно AKT, при этом контекстно-зависимая избыточность в регуляции субстрата является преобладающей особенностью сигнальной сети (см. Ниже).
, а не канонический остаток Arg (Berwick et al., 2002; Хорман и др., 2006). В настоящее время также признано, что даже наиболее хорошо зарекомендовавшие себя субстраты AKT не регулируются исключительно AKT, при этом контекстно-зависимая избыточность в регуляции субстрата является преобладающей особенностью сигнальной сети (см. Ниже).
Akt фосфорилирует нижележащие субстраты, участвующие в регуляции различных клеточных функций, включая многофункциональные субстраты. Показан неполный список известных подложек.P обозначает фосфорилирование, а красный и зеленый обозначают ингибирующую и активирующую регуляцию, соответственно.
Ключевые соображения для проверки кандидата-мишени AKT в качестве истинного субстрата и функции многих установленных мишеней были рассмотрены ранее (Manning and Cantley, 2007). Изоформы AKT выполняют специфичные для клеток и тканей функции, но, что наиболее заметно, активация AKT может способствовать выживанию, пролиферации, росту и изменениям клеточных метаболических путей через многочисленные нижестоящие мишени. В то время как AKT-опосредованное фосфорилирование многих из его субстратов имеет только одно физиологическое последствие, AKT также контролирует ключевые сигнальные узлы, которые впоследствии регулируют множество клеточных мишеней и функций (). В контексте сетевого представления о передаче сигналов AKT, мы выделяем три наиболее известных нижестоящих мишени AKT, которые также являются ключевыми узлами сигнализации, которые интегрируют сигнализацию AKT с дополнительными клеточными регуляторными цепями.
В то время как AKT-опосредованное фосфорилирование многих из его субстратов имеет только одно физиологическое последствие, AKT также контролирует ключевые сигнальные узлы, которые впоследствии регулируют множество клеточных мишеней и функций (). В контексте сетевого представления о передаче сигналов AKT, мы выделяем три наиболее известных нижестоящих мишени AKT, которые также являются ключевыми узлами сигнализации, которые интегрируют сигнализацию AKT с дополнительными клеточными регуляторными цепями.
Гликоген-синтаза-киназа 3 (GSK3)
Многофункциональная протеинкиназа Ser / Thr GSK3 была первым описанным субстратом AKT (Cross et al., 1995). Две изоформы, GSK3α и β, обладают 85% гомологией последовательностей и функционально избыточны в некоторых контекстах, но специфические для изоформы функции были идентифицированы в определенных тканях (Kaidanovich-Beilin and Woodgett, 2011). Посредством образования комплекса с отдельными сигнальными компонентами GSK3 участвует в разных сигнальных путях в клетках, в первую очередь в пути Wnt / β-catenin. Важно отметить, что регуляция GSK3 в таких путях, как полагают, не зависит от его регуляции с помощью передачи сигналов фактора роста через PI3K и AKT.GSK3 обычно активен в отсутствие экзогенных сигналов и, таким образом, резко инактивируется при стимуляции клеток факторами роста. AKT оказывает ингибирующее фосфорилирование на аминоконцевом мотиве, консервативном как в GSK3α (S21), так и в GSK3β (S9). Молекулярная природа этой регуляции проистекает из собственной субстратной специфичности GSK3, которая включает сильное предпочтение фосфорилированию остатков Ser / Thr, которые являются четырьмя амино-концевыми остатками по отношению к ранее фосфорилированному Ser / Thr (называемое праймированием в положении +4). .Фосфат из праймингового сайта на субстрате распознается фосфат-связывающим карманом в киназном домене GSK3, который позиционирует целевой остаток Ser / Thr для фосфорилирования соседним каталитическим сайтом киназы (Dajani et al., 2001; Frame et al., 2001; ter Haar et al., 2001).
Важно отметить, что регуляция GSK3 в таких путях, как полагают, не зависит от его регуляции с помощью передачи сигналов фактора роста через PI3K и AKT.GSK3 обычно активен в отсутствие экзогенных сигналов и, таким образом, резко инактивируется при стимуляции клеток факторами роста. AKT оказывает ингибирующее фосфорилирование на аминоконцевом мотиве, консервативном как в GSK3α (S21), так и в GSK3β (S9). Молекулярная природа этой регуляции проистекает из собственной субстратной специфичности GSK3, которая включает сильное предпочтение фосфорилированию остатков Ser / Thr, которые являются четырьмя амино-концевыми остатками по отношению к ранее фосфорилированному Ser / Thr (называемое праймированием в положении +4). .Фосфат из праймингового сайта на субстрате распознается фосфат-связывающим карманом в киназном домене GSK3, который позиционирует целевой остаток Ser / Thr для фосфорилирования соседним каталитическим сайтом киназы (Dajani et al., 2001; Frame et al., 2001; ter Haar et al., 2001).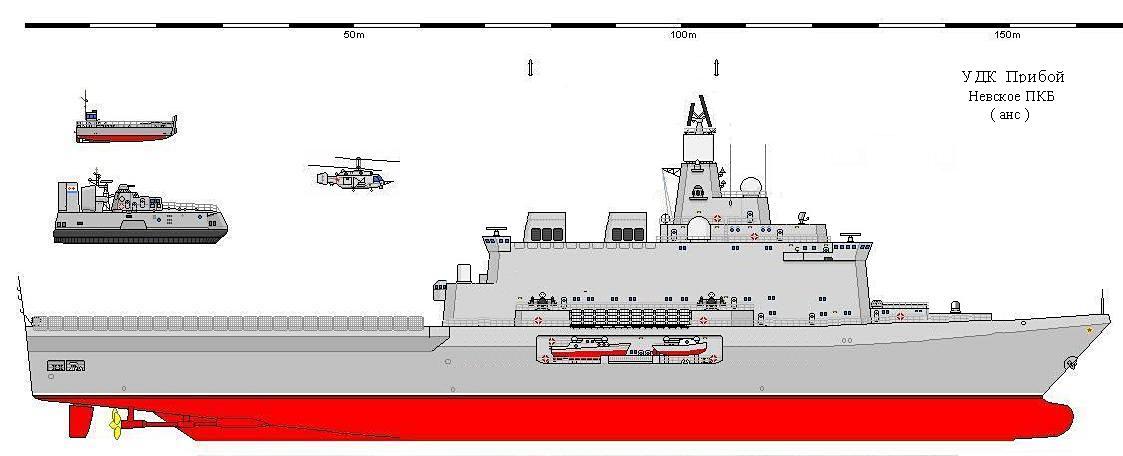 AKT-опосредованное фосфорилирование GSK3 на амино-конце создает внутримолекулярный псевдосубстрат, который блокирует фосфат-связывающий карман и ингибирует доступность субстрата для GSK3 (2).
AKT-опосредованное фосфорилирование GSK3 на амино-конце создает внутримолекулярный псевдосубстрат, который блокирует фосфат-связывающий карман и ингибирует доступность субстрата для GSK3 (2).
GSK3 распознает и фосфорилирует субстраты, которые ранее фосфорилировались праймирующей киназой.Показан неполный список известных субстратов GSK3. Фосфорилирование GSK3 в Akt инактивирует его, блокируя доступ к примированным субстратам.
GSK3 регулирует большой, функционально разнообразный набор прямых нижестоящих мишеней, большинство из которых ингибируются или деградируют при GSK3-опосредованном фосфорилировании (Kaidanovich-Beilin and Woodgett, 2011). Таким образом, передача сигналов фактора роста посредством AKT положительно регулирует эти мишени посредством ингибирования GSK3. Тот факт, что отдельные сигнальные пути и протеинкиназы ответственны за праймирование индивидуальных субстратов GSK3, добавляет дополнительный уровень сложности, который позволяет интегрировать регуляцию этих мишеней с помощью множественных входных сигналов. Фосфорилирование некоторых мишеней GSK3, участвующих в контроле выживаемости или пролиферации клеток, создает «фосфо-дегрон», который распознается специфическими E3-убиквитин-лигазами, которые впоследствии нацелены на субстрат для протеасомной деградации. К ним относятся член семейства MCL-1 для выживания BCL-2 (Ding et al., 2007; Maurer et al., 2006; Morel et al., 2009) и фактор транскрипции c-Myc (Sears et al., 2000; Welcker et al., 2004), которые примированы для распознавания GSK3 после фосфорилирования с помощью JNK и ERK, соответственно.Таким образом, передача сигналов AKT может стабилизировать эти белки путем ингибирования GSK3. GSK3 также регулирует клеточный метаболизм либо напрямую, через фосфорилирование и ингибирование метаболических ферментов, таких как одноименный субстрат гликогенсинтазы (GS) (Parker et al., 1983; Rylatt et al., 1980), либо косвенно, через ингибиторы. регуляция факторов транскрипции, которые глобально регулируют определенные метаболические программы, включая c-Myc, SREBP1c, HIF1α и NRF2 (Kaidanovich-Beilin and Woodgett, 2011).
Фосфорилирование некоторых мишеней GSK3, участвующих в контроле выживаемости или пролиферации клеток, создает «фосфо-дегрон», который распознается специфическими E3-убиквитин-лигазами, которые впоследствии нацелены на субстрат для протеасомной деградации. К ним относятся член семейства MCL-1 для выживания BCL-2 (Ding et al., 2007; Maurer et al., 2006; Morel et al., 2009) и фактор транскрипции c-Myc (Sears et al., 2000; Welcker et al., 2004), которые примированы для распознавания GSK3 после фосфорилирования с помощью JNK и ERK, соответственно.Таким образом, передача сигналов AKT может стабилизировать эти белки путем ингибирования GSK3. GSK3 также регулирует клеточный метаболизм либо напрямую, через фосфорилирование и ингибирование метаболических ферментов, таких как одноименный субстрат гликогенсинтазы (GS) (Parker et al., 1983; Rylatt et al., 1980), либо косвенно, через ингибиторы. регуляция факторов транскрипции, которые глобально регулируют определенные метаболические программы, включая c-Myc, SREBP1c, HIF1α и NRF2 (Kaidanovich-Beilin and Woodgett, 2011). У мышей, у которых отсутствуют сайты фосфорилирования AKT на GSK3α и β ( Gsk3α S21A ; Gsk3β S9A ), нарушен стимулируемый инсулином синтез гликогена в мышцах (McManus et al., 2005). Однако степень, в которой AKT-опосредованная регуляция GSK3 влияет на функции др. Субстратов GSK3, менее ясна.
У мышей, у которых отсутствуют сайты фосфорилирования AKT на GSK3α и β ( Gsk3α S21A ; Gsk3β S9A ), нарушен стимулируемый инсулином синтез гликогена в мышцах (McManus et al., 2005). Однако степень, в которой AKT-опосредованная регуляция GSK3 влияет на функции др. Субстратов GSK3, менее ясна.
Факторы транскрипции семейства Forkhead Box O (FoxO)
Факторы транскрипции FoxO, состоящие из FoxO1, 3, 4 и 6, контролируют разнообразный набор генных мишеней, которые, среди прочего, участвуют в адаптации к голоданию и низкой передача сигналов инсулина / IGF1 (van der Vos and Coffer, 2011; Webb and Brunet, 2014). Активация передачи сигналов PI3K-AKT приводит к острой транслокации белков FoxO из ядра и ослаблению их программы транскрипции (Brunet et al., 1999; Копс и др., 1999). AKT опосредует эту регуляцию посредством прямого фосфорилирования трех консервативных остатков этих факторов (). Фосфорилирование наиболее аминоконцевого сайта и второго сайта в последовательности ядерной локализации (NLS) на белках FoxO (T24 и S256 на FoxO1) генерирует мотивы узнавания для семейства 14-3-3 фосфосвязывающих белков, которые облегчают экспорт и секвестрация фосфорилированных белков FoxO в цитозоле (). Таким образом, передача сигналов AKT подавляет экспрессию мишеней FoxO, участвующих в индукции апоптоза (например,g., BIM и PUMA), остановка клеточного цикла (например, p21 и p27), катаболизм и ингибирование роста (например, Sestrin3, MAP1LC3B и BNIP3) и тканеспецифические метаболические изменения (например, PEPCK и G6PC) (van der Вос и Коффер, 2011; Уэбб и Брюнет, 2014).
Таким образом, передача сигналов AKT подавляет экспрессию мишеней FoxO, участвующих в индукции апоптоза (например,g., BIM и PUMA), остановка клеточного цикла (например, p21 и p27), катаболизм и ингибирование роста (например, Sestrin3, MAP1LC3B и BNIP3) и тканеспецифические метаболические изменения (например, PEPCK и G6PC) (van der Вос и Коффер, 2011; Уэбб и Брюнет, 2014).
A. Схема трех членов семейства FoxO с тремя консервативными сайтами фосфорилирования Akt, обозначенными относительно ДНК-связывающего домена (DBD), последовательность ядерной локализации (NLS) ) и ядерной экспортной последовательностью (NES). B. Akt-опосредованное фосфорилирование FoxO приводит к его связыванию и цитозольной секвестрации белками 14-3-3, тем самым ослабляя экспрессию его генов-мишеней, частичный список которых приведен.
Высококонсервативная генетическая связь между AKT и членами семейства FoxO обеспечивает окончательное доказательство жизненно важного регуляторного взаимодействия между передачей сигналов AKT и подавлением программы транскрипции FoxO. Эта связь была впервые обнаружена в C. elegans , где остановка стадии dauer, вызванная истощением двух изоформ AKT ( akt-1 и akt-2 ), была полностью устранена потерей единственного члена семейства FoxO (). daf-16 ) (Paradis and Ruvkun, 1998).У мышей специфическое для печени удаление Akt1 и Akt2 вызывает тяжелую печеночную инсулинорезистентность и гипергликемию, фенотипы, которые обращаются ко-делецией первичной изоформы FoxO в печени, Foxo1 (Lu et al. ., 2012). В совокупности эти исследования демонстрируют, что первичные фенотипы, вызванные потерей передачи сигналов AKT в этих условиях, управляются устойчивой транскрипцией, опосредованной FoxO. Таким образом, FoxO является ключевой нижестоящей мишенью передачи сигналов AKT для многих физиологических процессов (см. Ниже).
Эта связь была впервые обнаружена в C. elegans , где остановка стадии dauer, вызванная истощением двух изоформ AKT ( akt-1 и akt-2 ), была полностью устранена потерей единственного члена семейства FoxO (). daf-16 ) (Paradis and Ruvkun, 1998).У мышей специфическое для печени удаление Akt1 и Akt2 вызывает тяжелую печеночную инсулинорезистентность и гипергликемию, фенотипы, которые обращаются ко-делецией первичной изоформы FoxO в печени, Foxo1 (Lu et al. ., 2012). В совокупности эти исследования демонстрируют, что первичные фенотипы, вызванные потерей передачи сигналов AKT в этих условиях, управляются устойчивой транскрипцией, опосредованной FoxO. Таким образом, FoxO является ключевой нижестоящей мишенью передачи сигналов AKT для многих физиологических процессов (см. Ниже).
Комплекс 2 туберозного склероза (TSC2) и механистическая мишень комплекса рапамицина 1 (mTORC1)
PI3K и AKT играют эволюционно законсервированную роль в стимулировании роста клеток, тканей и организма ниже факторов роста, таких как IGF1. Эта регуляция в основном осуществляется посредством AKT-опосредованной активации протеинкиназного комплекса mTORC1, который стимулирует биосинтетические процессы, лежащие в основе роста клеток (Saxton and Sabatini, 2017). Первичный механизм, с помощью которого AKT активирует mTORC1, заключается в фосфорилировании и ингибировании комплекса 2 туберозного склероза (TSC2, также известного как туберин) (Inoki et al., 2002; Manning et al., 2002; Potter et al., 2002), который функционирует в составе белкового комплекса, также содержащего TSC1 и TBC1D7, вместе называемого комплексом TSC (). Через карбоксиконцевой домен TSC2 действует как GAP, специфичный для Ras-связанной GTPase Rheb, тем самым способствуя превращению Rheb-GTP в Rheb-GDP (Saxton and Sabatini, 2017). В своей GTP-связанной форме Rheb является важным активатором mTORC1. Таким образом, благодаря своей активности Rheb-GAP комплекс TSC является мощным ингибитором mTORC1.AKT-опосредованное фосфорилирование TSC2 снимает это ингибирование, чтобы активировать mTORC1.
Эта регуляция в основном осуществляется посредством AKT-опосредованной активации протеинкиназного комплекса mTORC1, который стимулирует биосинтетические процессы, лежащие в основе роста клеток (Saxton and Sabatini, 2017). Первичный механизм, с помощью которого AKT активирует mTORC1, заключается в фосфорилировании и ингибировании комплекса 2 туберозного склероза (TSC2, также известного как туберин) (Inoki et al., 2002; Manning et al., 2002; Potter et al., 2002), который функционирует в составе белкового комплекса, также содержащего TSC1 и TBC1D7, вместе называемого комплексом TSC (). Через карбоксиконцевой домен TSC2 действует как GAP, специфичный для Ras-связанной GTPase Rheb, тем самым способствуя превращению Rheb-GTP в Rheb-GDP (Saxton and Sabatini, 2017). В своей GTP-связанной форме Rheb является важным активатором mTORC1. Таким образом, благодаря своей активности Rheb-GAP комплекс TSC является мощным ингибитором mTORC1.AKT-опосредованное фосфорилирование TSC2 снимает это ингибирование, чтобы активировать mTORC1.
A. Схема компонентов комплекса TSC, их областей ассоциации (пунктирные линии) и сайтов фосфорилирования Akt на TSC2. Показаны консервативные домены с неизвестной функцией и домены компонентов GAP, coiled-coil и TBC. B. Модель интеграции сигналов факторов роста и аминокислот для регуляции mTORC1.Гетеродимер Rag взаимодействует с Ragulator и V-ATPase на лизосомальной поверхности, а аминокислоты способствуют связыванию mTORC1 с этим комплексом. Комплекс TSC поддерживает Реба в состоянии, связанном с ВВП. Akt, стимулированный фактором роста, фосфорилирует TSC2, что приводит к диссоциации с лизосомальной поверхности, позволяя Rheb загружаться GTP и активировать mTORC1. C. Сигнальный путь PI3K-mTOR, отображающий нижестоящие функции и регуляцию обратной связи.
Состояние активации mTORC1 контролируется интегрированным образом с помощью в значительной степени независимых сигналов, воздействующих на Rheb и второй класс малых GTPases, называемых Rags (Saxton and Sabatini, 2017). Гетеродимер изоформ Rag локализуется на цитоплазматической стороне лизосомы посредством взаимодействия с белковым комплексом, называемым Ragulator, который сам взаимодействует с лизосомальной V-АТФазой. Посредством различных механизмов восприятия состояние связывания гуаниновых нуклеотидов белков Rag изменяется в зависимости от доступности аминокислот таким образом, что влияет на их способность взаимодействовать с mTORC1. В присутствии аминокислот белки Rag рекрутируют mTORC1 на поверхность лизосомы, где проживает субпопуляция Rheb.В отсутствие факторов роста комплекс TSC ассоциируется с Rheb на лизосоме и поддерживает его в состоянии, связанном с GDP, неспособным активировать mTORC1 (Menon et al., 2014). Стимуляция фактора роста вызывает немедленное высвобождение комплекса TSC из Rheb в этом месте способом, который зависит от AKT и его пяти сайтов фосфорилирования на TSC2 (). Высвобождение комплекса TSC позволяет Rheb стать загруженным GTP и локально активировать mTORC1, рекрутируемый белками Rag.
Гетеродимер изоформ Rag локализуется на цитоплазматической стороне лизосомы посредством взаимодействия с белковым комплексом, называемым Ragulator, который сам взаимодействует с лизосомальной V-АТФазой. Посредством различных механизмов восприятия состояние связывания гуаниновых нуклеотидов белков Rag изменяется в зависимости от доступности аминокислот таким образом, что влияет на их способность взаимодействовать с mTORC1. В присутствии аминокислот белки Rag рекрутируют mTORC1 на поверхность лизосомы, где проживает субпопуляция Rheb.В отсутствие факторов роста комплекс TSC ассоциируется с Rheb на лизосоме и поддерживает его в состоянии, связанном с GDP, неспособным активировать mTORC1 (Menon et al., 2014). Стимуляция фактора роста вызывает немедленное высвобождение комплекса TSC из Rheb в этом месте способом, который зависит от AKT и его пяти сайтов фосфорилирования на TSC2 (). Высвобождение комплекса TSC позволяет Rheb стать загруженным GTP и локально активировать mTORC1, рекрутируемый белками Rag. Эта регуляторная цепь служит пространственным интегратором отдельных сигналов, гарантируя, что mTORC1 максимально активируется только тогда, когда достаточное количество внутриклеточных аминокислот ощущается выше белков Rag и экзогенный сигнал от факторов роста распространяется через AKT и комплекс TSC.
Эта регуляторная цепь служит пространственным интегратором отдельных сигналов, гарантируя, что mTORC1 максимально активируется только тогда, когда достаточное количество внутриклеточных аминокислот ощущается выше белков Rag и экзогенный сигнал от факторов роста распространяется через AKT и комплекс TSC.
Также стоит отметить, что AKT, как предполагается, непосредственно фосфорилирует mTOR на S2448 (Nave et al., 1999; Sekulic et al., 2000), и это фосфорилирование часто используется в качестве маркера активации mTORC1. Однако последующие исследования показали, что S2448 фосфорилируется S6K ниже mTORC1 (Chiang and Abraham, 2005; Holz and Blenis, 2005), и это фосфорилирование происходит на mTOR как внутри mTORC1, так и mTORC2 (Rosner et al., 2010). Более того, мутация S2448, по-видимому, не влияет на функцию mTOR, и ее функциональное значение остается неизвестным.Хотя фосфорилирование mTOR на S2448 может коррелировать с передачей сигналов mTORC1, эти факторы делают недействительным это фосфорилирование как специфический маркер активности mTORC1.
Богатый пролином субстрат AKT 40 кДа (PRAS40; также известный как AKT1S1) является другой мишенью AKT, участвующей в регуляции mTORC1 (Sancak et al., 2007; Vander Haar et al., 2007). PRAS40 — это белок с неизвестной функцией, который является второстепенным компонентом mTORC1. AKT фосфорилирует PRAS40 на T246 (Kovacina et al., 2003), и этот субстрат стал надежным считывающим устройством активности AKT в клетках и тканях.PRAS40 обладает ингибирующей активностью по отношению к mTORC1, которая ослабляется при фосфорилировании T246 (Sancak et al., 2007; Vander Haar et al., 2007). Однако роль фосфорилирования PRAS40 в передаче сигнала от AKT к активации mTORC1 остается неясной, с противоречивыми данными о том, приводит ли потеря PRAS40 к независимой от фактора роста активации mTORC1 (Sancak et al., 2007; Vander Haar et al., 2007). Это контрастирует с компонентами комплекса TSC, потеря которых приводит к полной AKT-независимой активации mTORC1, несмотря на то, что PRAS40 находится в дефосфорилированном состоянии в таких условиях (Sancak et al. , 2007). Более того, инсулин неспособен активировать передачу сигналов mTORC1 в клетках, лишенных сайтов фосфорилирования AKT на TSC2, несмотря на нормальную индукцию фосфорилирования PRAS40 (Menon et al., 2014). Таким образом, схема TSC-Rheb, по-видимому, доминирует над PRAS40 для регулирования mTORC1 с помощью Akt, по крайней мере, в некоторых настройках. Интересно, что PRAS40 также является субстратом mTORC1, и независимые исследования предполагают, что он может оказывать свой негативный регуляторный эффект через механизм конкуренции за субстрат (Fonseca et al., 2007; Оширо и др., 2007).
, 2007). Более того, инсулин неспособен активировать передачу сигналов mTORC1 в клетках, лишенных сайтов фосфорилирования AKT на TSC2, несмотря на нормальную индукцию фосфорилирования PRAS40 (Menon et al., 2014). Таким образом, схема TSC-Rheb, по-видимому, доминирует над PRAS40 для регулирования mTORC1 с помощью Akt, по крайней мере, в некоторых настройках. Интересно, что PRAS40 также является субстратом mTORC1, и независимые исследования предполагают, что он может оказывать свой негативный регуляторный эффект через механизм конкуренции за субстрат (Fonseca et al., 2007; Оширо и др., 2007).
Через свою регуляцию цепи TSC-Rheb-mTORC1 AKT служит для связи сигналов факторов роста с основным сигнальным узлом, контролирующим метаболические изменения, лежащие в основе роста клеток (Saxton and Sabatini, 2017). Активация mTORC1 способствует развитию множества анаболических процессов, таких как синтез белков, липидов и нуклеотидов, при подавлении катаболического процесса аутофагии. Кроме того, mTORC1 является как ключевым нижестоящим эффектором передачи сигналов PI3K-AKT, так и ингибитором пути, который оказывает сильные негативные эффекты обратной связи на активацию AKT с помощью RTK (см. Ниже).
Основные характеристики сигнальной сети AKT
Исследования сигнальной сети AKT с использованием все более сложных генетических, фармакологических, клеточно-биологических и биохимических подходов выявили сложную разводку этой разветвленной и петлевой сети и ее тесные регуляторные связи с другими клеточными сигналами. сети. Эти особенности являются ключом к пониманию распространения сигнала в сети, контекстно-зависимых клеточных ответов и неотъемлемых проблем нацеливания на сеть при заболеваниях человека.
Механизмы обратной связи
Как и все сигнальные пути, путь PI3K-AKT подвергается регуляции с отрицательной обратной связью, чтобы гарантировать, что стимулирующие сигналы воспринимаются и передаются временным образом. Сдвигающее количество отдельных механизмов отрицательной обратной связи, которые были идентифицированы для передачи сигналов PI3K-AKT, подчеркивают важность переключателя-подобного поведения для этого пути и что обратное выключение передачи сигналов AKT является столь же важным для правильной функции пути, как и его включение. Таким образом, несколько нижестоящих эффекторов передачи сигналов AKT также оказывают отрицательный регуляторный вклад в активацию AKT, тем самым действуя как реостаты, которые воспринимают передачу сигналов через этот путь и регулируют его активность.
Среди нижестоящих мишеней передачи сигналов AKT, mTORC1, по-видимому, играет особенно важную роль в ингибировании AKT с острой обратной связью посредством различных механизмов (). В течение многих лет было признано, что кратковременное лечение ингибитором mTORC1 рапамицином увеличивает чувствительность AKT к передаче сигналов RTK, особенно к инсулину и IGF1 (Manning, 2004). Большая часть этой регуляции приписывается mTORC1-зависимой деградации субстратов рецепторов инсулина (IRS) IRS1 и IRS2, которые служат в качестве адаптеров каркаса, связывающих рецепторы инсулина и IGF1 с активацией PI3K-AKT.Активация mTORC1 способствует деградации IRS1 / 2 посредством множественных событий фосфорилирования серина на этих белках, опосредованных mTORC1, S6K или другими неизвестными нижестоящими протеинкиназами, тем самым значительно подавляя активацию PI3K (Harrington et al., 2004; Shah and Hunter, 2006; Tzatsos and Kandror) , 2006). Таким образом, ингибирование mTORC1 увеличивает стабильность IRS1 / 2 и обеспечивает более надежную и устойчивую передачу сигналов инсулина / IGF1 к PI3K и AKT. Другой адаптерный белок, белок 10, связанный с рецептором фактора роста (GRB10), также оказался прямой мишенью для mTORC1, который негативно регулирует передачу сигналов RTK (Hsu et al., 2011; Ю. и др., 2011). Опосредованное mTORC1 фосфорилирование GRB10 стабилизирует белок и увеличивает его способность ослаблять передачу сигналов от рецепторов инсулина / IGF1 и белков IRS, тем самым блокируя активацию PI3K-AKT. Также существуют точки пересечения между mTORC1 и mTORC2, которые влияют на полную активацию AKT. S6K1-опосредованное фосфорилирование компонентов mTORC2 Rictor (T1135) и Sin1 (T86, T398) снижает mTORC2-зависимое фосфорилирование AKT-S473 (Dibble et al., 2009; Julien et al., 2010; Лю и др., 2013b). Любопытно, что эта регуляция mTORC2, по-видимому, не влияет на его активность по отношению к другим субстратам, включая AKT T450. Помимо передачи сигналов инсулина и IGF1, ингибиторы mTOR также усиливают активацию других RTK перед PI3K и AKT. Сюда входят члены семейства рецепторов EGF (EGFR, ErbB2 / Her2, Erb3 / Her3 и Erb4 / Her4), которые быстро активируются при ингибировании mTOR без немедленного воздействия на уровни рецепторов (Rodrik-Outmezguine et al., 2011). Хотя посттрансляционные механизмы, лежащие в основе этой регуляции, в настоящее время неизвестны, эффекты наиболее заметно проявляются с ингибиторами киназы mTOR, а не с аллостерическим ингибитором рапамицином.Поскольку этот класс соединений в равной степени ингибирует mTORC1 и mTORC2, часть этой регуляции обратной связи может быть опосредована передачей сигналов mTORC2.
Другие нижестоящие ветви передачи сигналов AKT также оказывают эффекты обратной связи на активацию AKT. В исследованиях рака использование фармакологических соединений, ингибирующих изоформы PI3K, AKT и / или mTOR, выявило надежную обратную регуляцию уровней белка RTK с помощью факторов транскрипции FoxO (Chandarlapaty et al., 2011; Muranen et al., 2012; Zhuang et al. al., 2013). Было обнаружено, что длительное ингибирование передачи сигналов AKT усиливает экспрессию рецепторов инсулина и IGF1 и HER3 посредством FoxO-зависимой индукции транскрипции, тем самым делая клетки более склонными к последующей опосредованной факторами роста активации передачи сигналов PI3K-AKT (Chandarlapaty et al., 2011) .
Перекрестная связь с другими основными сигнальными путями
Точки перекрестной регуляции между сигнальным путем PI3K-AKT и другими основными сигнальными путями являются общими. Эти точки интеграции действуют, чтобы либо непосредственно регулировать компоненты пути, либо сходиться в регуляции нижестоящих мишеней, контролируемых другими путями.Хотя вполне вероятно, что передача сигналов PI3K-AKT пересекается со всеми основными путями передачи сигналов в клетках в одной или нескольких точках, разнообразие и сложность механизмов перекрестных помех проиллюстрированы таковыми с путями RAS-ERK и AMPK ().
Перекрестные помехи и избыточность в сети AKTA. Существует несколько точек перекрестной регуляции между путем PI3K-Akt и как пути RAS-ERK, так и пути AMPK, что приводит как к регуляции реципрокного пути, так и к конвергентной регуляции нижестоящего. процессы. B. Различные киназы семейства AGC могут избыточно фосфорилировать перекрывающиеся сайты на ключевых нижестоящих субстратах AKT, тем самым изменяя регуляторный вклад в эти мишени.
Существует особенно тесная взаимосвязь между путями PI3K-AKT и RAS-ERK, где ингибиторы одного пути часто активируют другой (Mendoza et al., 2011). Одним из первых идентифицированных субстратов AKT была протеинкиназа c-Raf (или Raf1) (Rommel et al., 1999; Zimmermann and Moelling, 1999), которая активируется с помощью RAS и инициирует каскад киназ, завершающийся активацией ERK.AKT фосфорилирует c-RAF на S259 и эквивалентном сайте на B-RAF (S364), который ингибирует активацию RAF или передачу сигналов ниже по течению, способствуя связыванию с белками 14-3-3, особенно когда другие регуляторные сайты этих белков также фосфорилируются PKA. или AMPK (Dumaz and Marais, 2003; Guan et al., 2000; Shen et al., 2013; Zimmermann and Moelling, 1999). В дополнение к этой точке прямого перекрестного взаимодействия, многие механизмы обратной связи, присущие сигнальной сети AKT (обсуждаемые выше), оказывают свое влияние через сигнальные адаптеры RTK и каркасные адаптеры, которые активируют несколько митогенных сигнальных путей, включая RAS-ERK и PLCγ-PKC. пути.Активация ERK может также подавлять RTK-опосредованную индукцию пути PI3K-AKT посредством фосфорилирования каркасных адаптеров GAB1 и GAB2 (Mendoza et al., 2011). Беспристрастный скрининг siRNA по всей киноме показал, что ослабление передачи сигналов ERK приводит к общему усилению активации AKT, указывая тем самым на то, что вероятно существуют дополнительные механизмы ингибирования между этими путями (Lu et al., 2011). Пути PI3K-AKT и RAS-ERK также сходятся, чтобы регулировать многие из тех же нижестоящих эффекторов (например,g., TSC2, FOXO, GSK3) и клеточные процессы (Mendoza et al., 2011). Одним из ярких примеров этой конвергентной регуляции является контроль cap-зависимой трансляции. Это происходит частично за счет регуляции mTORC1 посредством ERK и RSK-опосредованного мультисайтового фосфорилирования как TSC2, так и компонента mTORC1 Raptor (Ma et al., 2005; Romeo et al., 2012; Roux et al., 2004). Подобно RSK, взаимодействующие с MAPK киназы (MNK1 и MNK2) активируются посредством передачи сигналов ERK. MNK1 / 2 фосфорилирует кэп-связывающий белок 5′-мРНК eIF4E, который, по-видимому, способствует его способности инициировать кэп-зависимую трансляцию (Siddiqui and Sonenberg, 2015).Этот регуляторный вход от передачи сигналов ERK происходит ниже опосредованного mTORC1 фосфорилирования белков 4E-BP, что стимулирует их высвобождение из-за ингибирующего связывания eIF4E. Таким образом, хотя пути PI3K-AKT и RAS-ERK могут перекрестно ингибировать друг друга, они также могут действовать совместно, чтобы надежно регулировать ключевые клеточные процессы, участвующие в росте и пролиферации клеток.
Передача сигналов AKT имеет несколько точек перекрестной регуляции с AMPK, основным сенсором клеточной энергии, который облегчает адаптацию к истощению АТФ ().Поскольку передача сигналов AKT способствует захвату глюкозы и гликолизу, она стимулирует выработку АТФ и тем самым косвенно предотвращает активацию AMPK. Однако было обнаружено, что AKT непосредственно фосфорилирует карбоксильный концевой остаток на AMPK (AMPKα1-S487), что препятствует активирующему фосфорилированию AMPK с помощью LKB1 (Hawley et al., 2014; Horman et al., 2006). Эта регуляция интересна в свете того факта, что AKT и AMPK обладают как избыточными, так и противодействующими функциями в регуляции клеточного метаболизма и роста.AMPK и AKT могут индуцировать захват глюкозы в метаболических тканях, таких как скелетные мышцы, посредством их соответствующего фосфорилирования и ингибирования RAB-GAPs TBC1D1 и TBC1D4 / AS160, что приводит к RAB-опосредованной транслокации GLUT4 к плазматической мембране (Chavez et al. ., 2008; Eguez et al., 2005; Sano et al., 2003). Хотя обе киназы стимулируют захват глюкозы, они делают это в ответ на различные сигналы: AKT в ответ на инсулин и AMPK в ответ на истощение АТФ, например, при сокращении мышц.С другой стороны, передача сигналов AKT, в основном за счет активации mTORC1, стимулирует анаболические процессы, потребляющие АТФ, тогда как активация AMPK блокирует анаболический метаболизм в пользу катаболических процессов, продуцирующих АТФ (Dibble and Manning, 2013; Mihaylova and Shaw, 2011). AKT и AMPK оказывают противоположное влияние на передачу сигналов mTORC1, синтез белков, липидов и гликогена, а также на индукцию аутофагии через множество общих и различных нижестоящих мишеней. Таким образом, перекрестная связь между этими повсеместными путями является ключевой контрольной точкой для адаптивного переключения между катаболическим и анаболическим состояниями в клетках и тканях.
Модульность и избыточность
В настоящее время хорошо известно, что передача сигналов имеет модульную природу и что субстраты AKT в одном контексте, специфичном для клетки и стимула, могут регулироваться протеинкиназами, связанными с AKT, в другом контексте. Эта избыточная регуляция субстратов позволяет ключевым регуляторным сайтам фосфорилирования на данном белке реагировать на более разнообразный набор вышестоящих входов, которые по-разному регулируют членов семейства киназ AGC. Эта избыточность происходит, в первую очередь, за счет киназ, регулируемых фактором роста, которые стимулируются аналогично (e.g., SGK, RSK, PKC) или ниже (например, S6K) сигнализации AKT. Хотя альтернативная регуляция посредством одного и того же мотива последовательности может иметь место для всех субстратов AKT, три узла передачи сигналов, подробно описанные выше, являются прекрасными примерами этой особенности сети передачи сигналов AKT (19). N-концевой ингибирующий сайт на изоформах GSK3 (GSK3α-S21, GSK3β-S9) может фосфорилироваться с помощью RSK или S6K, ниже передачи сигналов ERK или mTORC1, соответственно (Kaidanovich-Beilin and Woodgett, 2011). Секвестрации FOXO3a в цитозоле также может способствовать SGK-опосредованное фосфорилирование T32 (Brunet et al., 2001). Сигналы роста могут активировать передачу сигналов mTORC1 независимо от активности AKT, в том числе через путь ERK-RSK таким образом, который, как считается, включает RSK-опосредованное фосфорилирование по крайней мере двух сайтов AKT на TSC2 (S939 и T1462) вместе с дополнительными регуляторными сайтами ( Ma et al., 2005; Roux et al., 2004). Интересно, что SGK1 или SGK3 также могут заменять AKT для фосфорилирования TSC2 и индукции передачи сигналов mTORC1, что было обнаружено в раковых клетках при длительном воздействии фармакологических ингибиторов PI3K или AKT и обеспечивает механизм клеточной устойчивости к таким ингибиторам (Bago et al., 2016; Castel et al., 2016). В этих примерах кажется, что AKT является доминирующим регулятором, но это маловероятно для всех субстратов и настроек AKT.
Селективная передача сигналов к нисходящим ветвям
Учитывая разнообразные функции субстратов AKT, способность регулировать подмножества нижестоящих ветвей в различных условиях, по-видимому, является существенной особенностью. Однако, помимо дифференциальной экспрессии субстратов AKT в данном биологическом контексте, это плохо изученная область.Некоторые параметры, вероятно, вносят вклад в избирательную передачу сигналов к конкретным мишеням. Сила или продолжительность активации AKT может влиять на то, какие субстраты фосфорилируются. Одним из признаков этого свойства является ситуация, когда mTORC2 ингибируется генетически или фармакологически, тем самым блокируя фосфорилирование AKT S473, событие, необходимое для стабилизации фосфорилирования T308 для максимальной активации AKT (Alessi et al., 1996a). При потере mTORC2 индуцируются неизвестные механизмы стабилизации фосфорилирования T308, что приводит к устойчивой передаче сигналов AKT (Guertin et al., 2006; Jacinto et al., 2006). Единственным заметным исключением является AKT-опосредованное фосфорилирование изоформ FOXO, которое ослабляется в отсутствие mTORC2, несмотря на компенсацию T308. Одна интерпретация этих наблюдений заключается в том, что фосфорилирование FOXO и, возможно, других субстратов требует более высокого порога активности AKT по сравнению с другими субстратами AKT. Другой вероятный механизм, управляющий дифференциальным фосфорилированием субстратов, может быть через пространственные эффекты, влияющие на доставку AKT к его субстратам или наоборот, что является важной областью будущих исследований.
Для многих субстратов AKT свойства, присущие самому субстрату, и его контроль со стороны других регулирующих входов будут направлять определенные нисходящие выходы. Через специфические нижестоящие мишени передача сигналов AKT часто пересекается с клеточной реакцией на стресс и путями восприятия питательных веществ. В таких случаях сигналы от внутриклеточного стресса или истощения питательных веществ обычно преобладают над экзогенными сигналами от факторов роста и цитокинов, распространяемых путем PI3K-AKT. Например, противодействию AKT-опосредованной секвестрации членов семейства FoxO в цитозоле () является ряд путей, реагирующих на стресс и питательные вещества (например,g., p38, JNK, AMPK, SIRT1), которые также напрямую модифицируют факторы транскрипции FoxO и способствуют их ядерной транслокации и активации генных мишеней, многие из которых участвуют в адаптации к клеточному стрессу (Webb and Brunet, 2014). TSC2 и mTORC1 также подвергаются противоположной регуляции, которая ощущает истощение внутриклеточного АТФ или питательных веществ и преимущественно ингибирует способность передачи сигналов AKT активировать mTORC1 (Saxton and Sabatini, 2017). Интеграция этих различных сигналов гарантирует, что, независимо от состояния активации AKT, mTORC1 не будет активирован для стимулирования анаболических процессов, потребляющих энергию и питательные вещества, когда эти ресурсы ограничены.Такой способ интеграции сигналов на уровне специфических субстратов, особенно тех, которые также играют роль в регуляции AKT с обратной связью, вероятно, является ключом к соответствию соответствующего клеточного ответа на динамически изменяющееся клеточное состояние. Например, сигналы фактора роста для PI3K и AKT, полученные в клетке, лишенной питательных веществ, приведут к усилению передачи сигналов выживания от AKT без стимулирования роста клеток из-за ослабления передачи сигналов mTORC1 и его эффектов обратной связи на AKT.Кажется вероятным, что существуют другие такие механизмы, которые присущи специфическим субстратам AKT, которые направляют действие AKT на определенные цели и от других, тем самым адаптируя сигнал к состоянию клетки.
AKT Изоформ-специфические функции и субстраты
Большинство субстратов AKT фосфорилируются и функционально регулируются всеми тремя изоформами AKT. Однако был идентифицирован ряд субстратов, на которые однозначно нацелены AKT1, AKT2 или AKT3.Эта селективность к субстрату, вероятно, объясняет некоторые изоформ-специфические фенотипы, наблюдаемые в генетических исследованиях, предполагая уникальные свойства, присущие изоформам AKT или их регуляции, которые объясняют такую специфичность. Например, независимые исследования рака груди показали, что AKT1 подавляет миграцию и метастазирование, тогда как AKT2 способствует метастатическому распространению (Dillon et al., 2009; Hutchinson et al., 2004; Irie et al., 2005; Maroulakou et al., 2007). . Однако такие противоположные и неизбыточные функции изоформ AKT, вероятно, зависят от контекста.Например, в клетках рака предстательной железы с инактивацией PTEN AKT2 требуется исключительно для автономного по отношению к клеткам поддержания опухоли (Chin et al., 2014), тогда как у мышей Pten +/- изоформа AKT1, по-видимому, подавляет развитие опухоли простаты (Chen et al., 2006), тогда как удаление AKT2 оказывает незначительное влияние (Xu et al., 2012). Глобальные подходы к фосфопротеомному скринингу выявили сотни новых сайтов фосфорилирования, которые соответствуют консенсусному мотиву AKT, а также предоставили новое понимание потенциальных функций и субстратов, специфичных для изоформ AKT, многие из которых ждут дальнейшей проверки (Lee et al., 2014; Moniz et al., 2017; Санидас и др., 2014). Механизмы, которые, вероятно, вносят вклад в специфичность изоформ Akt для субстратов ниже по течению, включают молекулярные особенности индивидуальных изоформ, дискретную субклеточную локализацию и относительные уровни экспрессии в заданных условиях. Селективная активация конкретных изоформ AKT в определенных условиях также может вносить свой вклад (Kim et al., 2011). Наконец, наличие онкогенных активирующих соматических мутаций в AKT1, AKT2 или AKT3, вероятно, будет влиять на характер фосфорилирования специфического субстрата и сигнальный выход (Lien et al., 2016). В то время как механистические аспекты остаются интересной областью будущих исследований, накоплены четкие доказательства для AKT-изоформ-специфичного или -селективного фосфорилирования субстратов.
Физиология и патология передачи сигналов AKT
Учитывая широкий спектр субстратов и функций AKT, обнаруженных в ходе генетических, биохимических и клеточно-биологических исследований, неудивительно, что AKT играет центральную, но разнообразную роль в ответе различных типов клеток и ткани на гормоны, факторы роста, цитокины и нейротрофические факторы, среди других стимулов.Генетика мышей показывает, что AKT1, AKT2 и AKT3 имеют как повторяющиеся, так и специфические функции в разных тканях (Dummler and Hemmings, 2007). Все ткани, по-видимому, экспрессируют одну или несколько изоформ AKT, причем AKT1 является наиболее широко экспрессируемым, AKT2 обогащен инсулино-чувствительными метаболическими тканями, а AKT3 — в головном мозге. В соответствии с этим тканевым распределением, мыши Akt1 — / — демонстрируют задержку роста и перинатальную летальность (Chen et al., 2001; Cho et al., 2001b), у Akt2 — / — мышей развивается диабет. подобный синдром (Cho et al., 2001a), Akt3 — / — мышей демонстрируют уменьшенный размер мозга (Easton et al., 2005; Tschopp et al., 2005), а при нокауте соединений развивается ряд серьезных аномалий развития (Dummler and Hemmings, 2007). . Здесь мы представляем обзор наших текущих знаний о функции AKT в различных системах органов и о влиянии дисфункции AKT при определенных патологических состояниях ().
Таблица 1
Физиологические функции Akt и патологические последствия дисрегуляции Akt в различных типах клеток и тканях.
| Тип клеток / ткань | Функции | Ключевые цели | Возможные последствия заболевания * |
|---|---|---|---|
| Большинство типов клеток (эпителиальные или мезенхимальные, миграция, рост, выживание и выживание12) 90v481 | Многочисленные цели | Синдромы чрезмерного роста; аденома; гамартома; карцинома; саркома | |
| Эндотелиальные клетки и кровеносные сосуды | Выживание и ангиогенез | eNOS | Сосудистые аномалии; гемангиома; атеросклероз. |
| Врожденные иммунные клетки | Метаболизм и поляризация макрофагов; Снижение воспалительных сигналов от дендритных клеток; Хемотаксис нейтрофилов и респираторный взрыв | TSC-mTORC1, ACLY, FoxO1, GSK3 | Хронические воспалительные заболевания; сепсис |
| Лимфоциты | Выживание тимоцитов; Активация Th-клеток; Подавление Treg; Активация CTL ?; подавление Т-клеток памяти; Созревание В-клеток, выживаемость и переключение класса Ig; | TSC-mTORC1, FoxO1 | Аутоиммунные заболевания |
| Нейроны и ЦНС | Выживание нейронов; полярность и спецификация аксонов; синаптическая пластичность | TSC-mTORC1, GSK3, NFkB | Мегалэнцефалия; эпилепсия; аутизм; когнитивный дефицит; расстройства настроения; нейродегенеративные заболевания |
| Поджелудочная железа | Рост островков и выработка инсулина | TSC-mTORC1 | ? |
| Печень | Подавляет глюконеогенез; синтез липидов | FoxO, TSC-mTORC1 | Инсулинорезистентность, диабет 2 типа, гепатостеатоз |
| Жир | Поглощение глюкозы; подавление липолиза | TBC1D4, PDE3B, TSC-mTORC1, FoxO | Инсулинорезистентность; сахарный диабет 2 типа; липодистрофия |
| Мышцы | Поглощение глюкозы; синтез гликогена; синтез белка; подавление деградации белка | TBC1D4, GSK3, TSC-mTORC1, FoxO | Инсулинорезистентность; сахарный диабет 2 типа; саркопения |
| Гипоталамус | Подавление кормления | FoxO, TSC-mTORC1 | Гиперфагия, ожирение? |
| Сердце | Физиологическая гипертрофия | TSC-mTORC1 | Патологическая гипертрофия? |
Синдромы избыточного роста
Множественные различные синдромы избыточного роста у людей были связаны с одним или несколькими генетическими дефектами в сигнальной сети PI3K-AKT.Все генетические поражения, которые причинно связаны с этими синдромами, вызывают конститутивное усиление передачи сигналов AKT-TSC-mTORC1 и включают амплификацию или мутации соматической мозаики в PIK3CA , всех трех изоформах AKT или mTOR , или мутации, инактивирующей зародышевые линии. в PTEN или компоненты комплекса TSC (Keppler-Noreuil et al., 2014). Клинические проявления этих нарушений чрезмерного роста варьируются от небольших повреждений кожи до чрезмерного разрастания множества тканей и повышенной восприимчивости к опухоли.Например, спектр избыточного роста, связанный с PIK3CA (PROS), представляет собой врожденный синдром избыточного роста в раннем детстве, при котором пациенты подвергаются риску развития злокачественных новообразований, что согласуется с активацией мутаций горячих точек PIK3CA в E545K и h2047R, которые часто возникают при спорадических карциномах (Samuels и др., 2004). Синдром Протея (PS) представляет собой отчетливую прогрессирующую аномалию чрезмерного роста, при которой у пораженных людей есть склонность к развитию ряда доброкачественных опухолей. Генетической основой PS является усиление функциональной мутации AKT1 на E17K в домене PH (Lindhurst et al., 2011). У больных развивается прогрессирующее разрастание большинства органов и тканей в дополнение к серьезным сосудистым мальформациям. Пациенты с активирующими мутациями в AKT2 на E17K не развивают PS, но вместо этого обнаруживают тяжелую инсулиннезависимую гипогликемию, асимметричный избыточный рост и ожирение (Hussain et al., 2011). У пациентов с эквивалентной мутацией AKT3 E17K развивается чрезмерный рост мозга и мегалэнцефалия (Poduri et al., 2012). Нисходящая ветвь TSC-mTORC1, по-видимому, особенно важна в управлении избыточным ростом при этих синдромах, связанных с активацией пути PI3K-Akt, при этом у пациентов часто наблюдается улучшение после лечения ингибиторами mTORC1.
Рак
Множественные генетические поражения вызывают гиперактивацию AKT в солидных опухолях человека и гематологических злокачественных новообразованиях. К ним относятся амплификация или повторяющиеся онкогенные соматические мутации в EGFR , HER2 или других RTK, PDK1 , и PIK3CA . Точно так же инактивирующие мутации или потеря гетерозиготности в генах-супрессорах опухолей, таких как PTEN , INPP4B и PHLPP , также приводят к гиперактивации AKT (обзор в (Mayer and Arteaga, 2016)).Однако активация AKT не всегда соответствует мутации PIK3CA (Vasudevan et al., 2009), и другие эффекторы PI3K также могут вносить вклад в злокачественность (Lien et al., 2017). Хотя AKT наиболее часто активируется при раке человека посредством мутаций, затрагивающих вышестоящие регуляторы, сами три изоформы AKT являются онкогенами bona fide .
Хотя и с более низкими частотами, чем основные регуляторы Akt, такие как PIK3CA, амплификационные или активирующие мутации в генах AKT были идентифицированы во множественных солидных опухолях (Altomare and Testa, 2005).Первой описанной соматической активирующей мутацией любого гена AKT была мутация E17K в домене PH AKT1 у пациентов с раком груди (Carpten et al., 2007). AKT1 E17K представляет собой повторяющуюся мутацию с низкой частотой (1,5–9%) при раке молочной железы (Rudolph et al., 2016). Эта мутация обеспечивает конститутивную активацию киназы из-за переключения заряда на Glu17 в фосфоинозитид-связывающем кармане домена PH, что делает возможным конститутивную мембранную локализацию Akt (Carpten et al., 2007; Landgraf et al., 2008).Однако AKT1 E17K неспособен способствовать онкогенезу в отсутствие других мутаций драйвера (Lauring et al., 2010; Mancini et al., 2016). Подобно мутации PIK3CA, мутации AKT E17K обнаруживаются при раке молочной железы, положительном по эстрогеновым рецепторам (ER), предполагая, что активация пути PI3K-AKT дает селективное преимущество в этой линии (Salhia et al., 2012). Также примечательно, что в дополнение к E17K были описаны другие активирующие мутации в AKT1 при раке человека (Yi and Lauring, 2016).В то время как эквивалентная мутация AKT2 E17K была идентифицирована у одного пациента с раком молочной железы, несмотря на крупномасштабные усилия по секвенированию (Stephens et al., 2012), AKT2 E17K, по-видимому, не является повторяющимся событием при раке молочной железы. Напротив, эквивалент AKT3 E17K был идентифицирован как повторяющаяся мутация, особенно при меланоме (Davies et al., 2008). Во всех этих случаях ряд нижестоящих эффектов передачи сигналов AKT, способствующих выживанию и росту, включая изменения клеточного метаболизма, вероятно, вносят вклад в его роль в росте и прогрессии опухоли (Manning and Cantley, 2007).
Функция эндотелиальных клеток, ангиогенез и биология сосудов
Сигнальная сеть AKT играет важную функциональную роль в клетках, которые часто нерегулируются при сосудистых аномалиях, включая эндотелиальные клетки (ЭК), гладкомышечные клетки сосудов (VSMC) и макрофаги. AKT1, по-видимому, является основной изоформой, которая способствует нормальным физиологическим функциям ЭК, а активация AKT1 фактором роста эндотелия сосудов (VEGF) стимулирует пролиферацию, миграцию и выживаемость ЭК (Chen et al., 2005). Это согласуется с открытием, что эндотелиальная синтаза оксида азота (NO) (eNOS), которая контролирует сосудистый тонус, является AKT1-специфическим субстратом в эндотелиальных клетках (Lee et al., 2014). Таким образом, потеря AKT1, но не AKT2, в ЭК мыши приводит к снижению высвобождения NO и нарушению ангиогенеза (Ackah et al., 2005). AKT1 также участвует в ремоделировании сосудов. Экспрессия активированного аллеля AKT1 в ЭК блокирует образование неоинтимальных повреждений после повреждения артерии (Mukai et al., 2006) и вызывает патологический ангиогенез, сопровождающийся повышенной проницаемостью сосудов (Phung et al., 2006).
AKT1 является преобладающей изоформой, экспрессируемой в VSMC, и способствует пролиферации, выживанию и миграции клеток VSMC, при этом потеря Akt1 усиливает развитие и тяжесть атеросклероза в моделях мышей (Fernandez-Hernando et al., 2007; Fernandez-Hernando et al. ., 2009). Атеросклероз — это широко распространенное сердечно-сосудистое заболевание, при котором преобладает образование локализованных сосудистых бляшек, состоящих из нагруженных липидами макрофагов, называемых пенистыми клетками.Изоформы AKT выполняют заметные функции в макрофагах, связанные с врожденным иммунитетом (см. Ниже), но также было обнаружено, что они влияют на образование пенистых клеток. У мышей, лишенных AKT2, но не AKT1 в гемопоэтических клетках, наблюдается уменьшение атеросклеротических поражений (Babaev et al., 2014). Напротив, мыши с нокаутом AKT3 имеют усиленное развитие атеросклероза из-за увеличения образования пенистых клеток, что, по-видимому, является внутренним свойством Akt3-дефицитных макрофагов в результате повышенного поглощения липопротеинов (Ding et al., 2012). Вместе с критическими функциями Akt1 в EC и VSMC, три изоформы Akt играют сложную, но критическую роль в здоровье сосудов и заболеваниях.
Инсулиновый ответ и системный метаболизм
У многоклеточных животных передача сигналов AKT эволюционировала совместно с передачей сигналов инсулина и IGF1, причем PI3K-зависимая активация AKT является первичным эффекторным путем для этих гормонов в модельных организмах, включая червей, мух и грызунов. У млекопитающих инсулино-опосредованная активация AKT является центральной для правильного удаления глюкозы и других метаболических адаптаций после кормления за счет различных действий в метаболических тканях.Данные свидетельствуют о том, что активация AKT1 в клетках островков поджелудочной железы увеличивает массу β-клеток и продукцию инсулина (Buzzi et al., 2010). Цепь TSC-Rheb-mTORC1 является вероятным последующим эффектором для этой функции, поскольку специфическая активация mTORC1 островковыми клетками приводит к устойчивому росту островков, гиперинсулинемии и улучшенной толерантности к глюкозе (Howell and Manning, 2011). Постпрандиальная секреция инсулина из поджелудочной железы инициирует системный метаболический ответ, который требует определенных функций AKT в основных инсулино-чувствительных тканях, включая печень, мышцы и жир.С некоторой частичной избыточностью от AKT1, AKT2, по-видимому, является доминирующей функциональной изоформой в этих тканях для ответа на инсулин. Таким образом, мыши с нокаутом Akt2 и проявляют резистентность к инсулину и непереносимость глюкозы и страдают диабетом 2 типа (Cho et al., 2001a; Garofalo et al., 2003). Интересно, что редкие доминантно-отрицательные мутации в AKT2 лежат в основе генетического развития тяжелого диабета у людей (George et al., 2004). Важно отметить, что передача сигналов AKT ослаблена в метаболических тканях в инсулинорезистентном состоянии, которое лежит в основе диабета 2 типа.Инсулинорезистентность возникает, по крайней мере частично, за счет хронической активации механизмов обратной связи и перекрестных помех, присущих сигнальной сети PI3K-AKT (см. Выше). Снижение способности активировать AKT нарушает основные метаболические действия инсулина.
Передача сигналов инсулина AKT в печени важна для подавления продукции глюкозы в печени и для стимуляции синтеза липидов (Dummler et al., 2006; Leavens et al., 2009; Ono et al., 2003). Инсулин подавляет глюконеогенез в гепатоцитах посредством AKT-опосредованного фосфорилирования и ингибирования FoxO1, который в состоянии натощак находится в ядре и индуцирует экспрессию ключевых глюконеогенных ферментов фосфоенолпируваткарбоксикиназы (PEPCK) и глюкозо-6-фосфатазы (G6Potoase и др.) (Matsum ., 2007; Puigserver et al., 2003). Поразительно, что неконтролируемое производство глюкозы в печени и инсулинорезистентность у мышей с печеночно-специфической потерей A kt1 и Akt2 обращаются ко-делецией Foxo1 (Lu et al., 2012), обеспечивая окончательные генетические доказательства того, что ингибирование FoxO1 является важной функцией AKT в печени. Особенно неожиданным следствием этого открытия является то, что в отсутствие FoxO1 передача сигналов AKT в печени оказывается незаменимой для контроля метаболизма глюкозы при голодании и кормлении.Передача сигналов AKT может также снижать высвобождение глюкозы в печени, направляя глюкозо-6-фосфат в сторону синтеза гликогена. Однако было обнаружено, что стимулируемое инсулином AKT2-зависимое стимулирование синтеза гликогена в печени происходит посредством неизвестного механизма, который не зависит от фосфорилирования GSK3 (Wan et al., 2013). Передача сигналов инсулина и AKT в печени также усиливает синтез липидов de novo, по крайней мере частично, посредством активации фактора транскрипции SREBP1c (Leavens et al., 2009).Ниже AKT, mTORC1 играет главную роль в активации изоформ SREBP, чтобы способствовать синтезу липидов de novo (Duvel et al., 2010; Porstmann et al., 2008). Было обнаружено, что индукция SREBP1c и синтеза липидов в печени зависит как от AKT2, так и от mTORC1, при этом подавление FoxO1 также вносит свой вклад в эту ситуацию (Wang et al., 2015).
Другой важный эффект инсулина на системный метаболизм заключается в подавлении липолиза и высвобождения жирных кислот из жировой ткани, что также влияет на системную чувствительность к инсулину (Czech et al., 2013). Ингибирование липолиза достигается, по крайней мере частично, за счет подавления передачи сигналов катехоламином к PKA, которая индуцирует липолиз в состоянии натощак за счет активации ацилглицеринлипаз, включая липазу триглицеридов жиров (ATGL) и гормоночувствительную липазу ( HSL). Передача сигналов PKA способствует доступу ATGL и HSL к богатой триглицеридами липидной капле адипоцитов, а передача сигналов инсулина ослабляет этот эффект.
Однако существенная роль AKT в способности инсулина подавлять липолиз полностью не установлена.Жировоспецифический нокаут компонента Rictor mTORC2, который приводит к ослаблению передачи сигналов AKT, приводит к неспособности инсулина блокировать липолиз (Kumar et al., 2010), но мыши, лишенные AKT2, демонстрируют только частичный дефект в опосредованном инсулином подавлении липолиза (Корен и др., 2015). Было обнаружено, что AKT непосредственно фосфорилирует фосфодиэстеразу 3B (PDE3B) на S273, что, по-видимому, увеличивает его способность гидролизовать цАМФ, тем самым блокируя активацию PKA (Kitamura et al., 1999). В соответствии с тем, что это ключевой момент регуляции, инсулин не может ингибировать липолиз у мышей с нокаутом PDE3B (Choi et al., 2006). Однако способность инсулина блокировать липолиз восстанавливается у PDE3B-нулевых адипоцитов с повторной экспрессией PDE3B дикого типа или мутанта по сайту фосфорилирования (S273A), что позволяет предположить, что другие регуляторные сайты PDE3B или параллельный механизм также необходимы для это регулирование (DiPilato et al., 2015). Опосредованное рапамицином ингибирование mTORC1 ниже Akt приводит к увеличению липидов плазмы у людей (Morrisett et al., 2002), а мыши с нокаутом S6K1 демонстрируют аналогичный фенотип с соответствующим снижением ожирения (Um et al., 2004). Эти эффекты приписывают роли mTORC1 в подавлении липолиза, поскольку ингибирование mTORC1 вызывает липолиз в культивируемых адипоцитах, что коррелирует с повышенной экспрессией ATGL и PKA-зависимым активирующим фосфорилированием HSL (Chakrabarti et al., 2010; Soliman et al., 2010). Недавние исследования также показали, что процесс аутофагии, который резко ингибирует mTORC1, тесно связан с индукцией липолиза (Cingolani and Czaja, 2016).
Клиренс циркулирующей глюкозы за счет поглощения жировой тканью и особенно скелетными мышцами индуцируется инсулином через активацию AKT, преимущественно AKT2 (Cho et al., 2001a; Гарофало и др., 2003). Инсулино-стимулированная передача сигналов PI3K-AKT ведет к быстрой транслокации первичного переносчика глюкозы в этих тканях, GLUT4, к плазматической мембране (Leto and Saltiel, 2012). Было обнаружено, что AKT2 ассоциируется с GLUT4-содержащими везикулами и способствует их транспортировке и слиянию плазматических мембран в ответ на инсулин (Calera et al., 1998; Ng et al., 2008). AKT, по-видимому, фосфорилирует несколько прямых нижестоящих мишеней, которые регулируют экзоцитоз этих пузырьков (Leto and Saltiel, 2012).Лучше всего из них охарактеризован Rab-GAP TBC1D4 (или AS160), который удерживает везикулы, содержащие Glut4, в цитозоле, функция, которая нарушается AKT-опосредованным фосфорилированием множества регуляторных сайтов, приводящим к связыванию TBC1D4 с 14-3. -3 (Eguez et al., 2005; Ramm et al., 2006; Sano et al., 2003). Впоследствии вновь приобретенная глюкоза в результате опосредованного GLUT4 поглощения сохраняется в виде гликогена в скелетных мышцах за счет действия гликогенсинтазы, которая активируется передачей сигналов AKT посредством фосфорилирования и ингибирования GSK3 (McManus et al., 2005).
Передача сигналов Akt в ответ на инсулин и IGF1 в скелетных мышцах также усиливает синтез белка, ослабляя распад белка (Egerman and Glass, 2014). Благодаря индукции синтеза белка и ингибированию аутофагии передача сигналов mTORC1 является основным драйвером гипертрофии мышц, стимулированной IGF1 (Ohanna et al., 2005; Rommel et al., 2001). Специфический для скелетных мышц нокаут mTORC1 приводит к мышечной дистрофии (Bentzinger et al., 2008), и устойчивой передачи сигналов mTORC1 достаточно для преодоления атрофии во время иммобилизации мышц (You et al., 2015). Однако конститутивная активация mTORC1 в мышцах может со временем приводить к органной дисфункции и миопатии из-за хронического ингибирования аутофагии (Castets et al., 2013). Интересно, что генетическая активация mTORC1 во время денервации, которая обычно подавляет его активность, усиливает атрофию мышц, по крайней мере, частично за счет подавления обратной связи передачи сигналов AKT к факторам транскрипции FoxO (Tang et al., 2014). AKT подавляет распад мышечного белка за счет ингибирования FoxO, тем самым блокируя экспрессию генов, кодирующих основные мышечные E3-убиквитинлигазы атрогин-1 и MuRF1 (Lee et al., 2004; Sandri et al., 2004; Stitt et al., 2004). Способствуя увеличению мышечной массы с помощью таких механизмов, передача сигналов AKT в скелетных мышцах может улучшить системный метаболизм и преодолеть вызванное диетой ожирение (Izumiya et al., 2008).
В качестве системного механизма отрицательной обратной связи инсулин и лептин действуют на гипоталамус, подавляя потребление пищи, стимулируя передачу сигналов AKT FoxO и mTORC1. Гипоталамический FoxO1 способствует потреблению пищи за счет индукции транскрипции нейропептида Y (NPY) и агути-родственного пептида (AgRP), двух основных орексигенных пептидов (Kim et al., 2006). AKT-опосредованное ингибирование FoxO1 в нейронах, продуцирующих NPY / AgRP, блокирует синтез этих пептидов в ответ на инсулин или лептин. Продукция NPY и AgRP также блокируется гипоталамической передачей сигналов mTORC1-S6K1, тем самым обеспечивая дополнительный подавляющий сигнал при приеме пищи (Blouet et al., 2008; Cota et al., 2006). Необходимы дополнительные исследования, чтобы понять роль передачи сигналов AKT в других областях мозга, которые влияют на пищевое поведение и потенциальные патофизиологические функции нарушения регуляции AKT при нарушениях питания.
Иммунитет и аутоиммунные заболевания
Путь PI3K-AKT играет разнообразную роль как в миелоидных клетках врожденной иммунной системы, так и в лимфоидных клетках адаптивной иммунной системы. В то время как иммунологические функции сигнальной сети AKT — довольно широкая и активная область исследований, основное внимание здесь уделяется установившимся автономным функциям клеток в этих клонах.
Различные стимулы могут активировать AKT в миелоидных клетках, включая специфические факторы роста, цитокины (например,g., IL-4) и лиганды для toll-подобных рецепторов (TLR; например, липополисахарид (LPS)) и GPCR (например, fMet-Leu-Phe (fMLP)). Активация AKT стимулирует аналогичный набор нижестоящих эффекторов по всему миелоидному клону, но то, как эти сигналы влияют на воспалительное действие каждой клетки, варьируется и в большинстве случаев не очень хорошо определено. AKT стал медиатором поляризации макрофагов в ответ на различные стимулы (Covarrubias et al., 2015; Weichhart et al., 2015). Поляризация относится к специализированным состояниям, принимаемым активированными макрофагами (например,g., провоспалительное или противовоспалительное), которые продиктованы интеграцией различных экзогенных сигналов и изменениями метаболического статуса клетки. Наряду с континуумом функциональных состояний состояние M1 является классическим провоспалительным антимикробным макрофагом, стимулируемым LPS, тогда как состояние M2 опосредует восстановление тканей, фиброз и реакцию на паразитарные инфекции и индуцируется IL-4. Хотя поляризационные сигналы M1 и M2 активируют AKT, большинство генетических и фармакологических данных свидетельствуют о том, что передача сигналов AKT способствует особенностям поляризации макрофагов M2 (Covarrubias et al., 2015; Weichhart et al., 2015). Однако сообщалось о различных эффектах для нокаутов, специфичных для изоформ AKT, с Akt1, нулевыми макрофагами, поляризованными в сторону состояния M1, и Akt2, нулевых макрофагов в сторону M2 (Arranz et al., 2012; Babaev et al., 2014). Что лежит в основе этого очевидного функционального различия, точно не определено, но предполагает, что AKT2 может противодействовать действию AKT1, способствуя поляризации M2. Схема TSC-mTORC1, по-видимому, играет важную роль в управлении этим процессом.Генетические модели мышей предполагают, что активация mTORC1 противостоит M2-поляризационным эффектам передачи сигналов PI3K-AKT, при этом механизмы отрицательной обратной связи доминируют в этой регуляции (Byles et al., 2013; Jiang et al., 2014; Zhu et al., 2014). В соответствии с mTORC1, функционирующим ниже AKT в обеспечении поляризации M2, рапамицин, как было обнаружено, избирательно убивает макрофаги M2 человека, одновременно усиливая поляризацию M1 (Mercalli et al., 2013). Изменения клеточного метаболизма, по-видимому, лежат в основе поляризации макрофагов (Covarrubias et al., 2015; Weichhart et al., 2015). Интересно, что недавно было обнаружено, что AKT-индуцированное поглощение глюкозы, гликолиз и продукция цитозольного ацетил-КоА способствуют поляризации M2 за счет усиления экспрессии генов конкретных мишеней в программе M2, эффект в значительной степени приписывается эпигенетическим изменениям за счет направленного ацетилирования гистонов (Covarrubias et al. др., 2016). Повышение ACLY-активирующего фосфорилирования и уровней белка ниже AKT и mTORC1 было ответственным за увеличение ацетил-КоА, доступного для модификаций хроматина.Один механизм, с помощью которого передача сигналов AKT может подавлять поляризацию M1 в пользу M2, заключается в его ингибировании FoxO1, который способствует экспрессии ключевых генов M1, участвующих в передаче сигналов воспаления, таких как TLR4 (Fan et al., 2010). Передача сигналов PI3K-AKT в дендритных клетках, по-видимому, ослабляет воспалительные сигналы, по крайней мере частично, за счет увеличения экспрессии противовоспалительного цитокина IL-10 при одновременном снижении экспрессии провоспалительного цитокина IL-12 (Weichhart et al., 2015) . Комбинированные эффекты ветвей TSC-mTORC1, FoxO1 и GSK3 передачи сигналов AKT, вероятно, вносят вклад в эту регуляцию.Кроме того, было предположено, что процесс аутофагии, ингибируемый mTORC1, играет ключевую роль в процессинге антигена и его презентации дендритными клетками (Jagannath et al., 2009). В нейтрофилах контроль полярности клеток и хемотаксической миграции является ключом к их быстрой реакции на инфекцию или повреждение ткани. PI3Kγ, AKT2 и GSK3 участвуют в реакции нейтрофилов на агонисты GPCR (например, fMLP), при этом генетика мышей демонстрирует заметную роль как в хемотаксисе нейтрофилов, так и в индукции респираторного взрыва, участвующего в уничтожении микробов (Chen et al., 2010b; Hirsch et al., 2000; Ли и др., 2000; Лю и др., 2010; Tang et al., 2011). Как и в клонах макрофагов, противоположные функции изоформ AKT наблюдаются в нейтрофилах, при этом нейтрофилы с дефицитом Akt1 и обнаруживают усиленную миграцию и уничтожение бактерий (Liu et al., 2013a). Эти генетические исследования показывают, что AKT2 способствует мобилизации и активации нейтрофилов, в то время как AKT1 оказывает подавляющее действие.
Передача сигналов PI3K играет разнообразную и критическую роль в функциях Т-клеток и В-клеток в адаптивной иммунной системе (So and Fruman, 2012).В лимфоцитах преимущественно изоформа PI3Kδ активируется Т-клеточным рецептором (TCR), B-клеточным рецептором (BCR) и различными корецепторами и рецепторами цитокинов, что приводит к активации AKT и других эффекторов ( Okkenhaug et al., 2002). Важность правильного связывания временной активации PI3K-AKT с этими скоординированными иммунными сигналами подчеркивается разнообразием функциональных моделей мышей, которые вызывают тяжелые лимфопролиферативные и аутоиммунные нарушения (Borlado et al., 2000; Парсонс и др., 2001; Судзуки и др., 2001). AKT важен для стимулированного поглощения питательных веществ, необходимых для выживания и увеличения популяций тимоцитов, до дифференцировки в специфические клоны Т-клеток (Juntilla et al., 2007). Существуют различные классы CD4 + Т-хелперных (Th) клеток, которые определяются производимыми ими цитокинами, которые по-разному влияют на активность других клеток как врожденной, так и адаптивной иммунной системы. Дифференцировка и клональная экспансия этих популяций включает передачу сигналов AKT в цепь TSC-mTORC1 и членов семейства FOXO, которые способствуют дифференцировке клеток Th2, Th3 и Th27, препятствуя развитию иммуносупрессивных Treg (Delgoffe et al., 2009; Delgoffe et al., 2011; Gerriets et al., 2016; Kerdiles et al., 2010; Ouyang et al., 2010). Хотя антиген и цитокиновая стимуляция CD8 + Т-клеток активируют путь PI3K-AKT, функциональные последствия этого сигнала не совсем ясны (Macintyre et al., 2011). Однако mTORC1 играет важную роль в дифференцировке и размножении CD8 + цитотоксических Т-лимфоцитов (CTL), в то же время подавляя развитие CD8 + Т-клеток памяти (Pollizzi et al., 2015). Как и в случае с другими типами клеток (Duvel et al., 2010), активация mTORC1 способствует захвату глюкозы, гликолизу и синтезу липидов, чтобы управлять дифференцировкой и анаболической пролиферацией клеток как в Th-клетках, так и в CTL, в то время как эти метаболические изменения, по-видимому, подавляют функции Treg и клеток памяти (Gerriets et al., 2016; Kidani et al. al., 2013; Pollizzi et al., 2015; Shi et al., 2011). В развитии B-клеток передача сигналов PI3K-AKT необходима для перехода про-B-клеток в IgM-экспрессирующие незрелые B-клетки (Okkenhaug et al., 2002). Этот процесс требует подавления локусов гена активации рекомбинации (RAG) Rag1 и Rag2 , что опосредуется AKT-зависимым ингибированием FoxO1, активатора транскрипции этих генов (Amin and Schlissel, 2008).Передача сигналов AKT к FoxO1 также играет ключевую роль в созревании и выживании популяций периферических B-клеток и переключении классов Ig (Calamito et al., 2010; Chen et al., 2010a; Omori et al., 2006).
Внутренние функции противоположных клеток различных изоформ AKT в разных миелоидных и лимфоидных клонах, вместе с критической связью между этими популяциями врожденных и адаптивных иммунных клеток, которая варьируется в зависимости от данной проблемы, делает интерпретацию исследований с использованием нокаутов изоформ AKT по всему телу или системное введение ингибиторов PI3K, AKT или mTOR, вызывающих проблемы на механистическом уровне.
Нейрональные функции и неврологические расстройства
Передача сигналов AKT играет важную роль в выживании, росте, полярности, синаптической пластичности и схемотехнике нейронов, тем самым влияя на развитие и функционирование мозга с последствиями для разнообразного набора неврологических расстройств. В развивающемся головном мозге передача сигналов PI3K-AKT активируется множеством ростовых и нейротрофических факторов (например, IGF1, фактора роста нервов (NGF), нейротрофического фактора мозга (BDNF)) и контролирует выживание и морфологию нейронов.AKT-опосредованное ингибирование проапоптотического белка Bad и факторов транскрипции Foxo способствует выживанию нервных клеток (Brunet et al., 1999; Datta et al., 2000). Локальная активация пути PI3K-AKT и его ингибирующее фосфорилирование GSK3 стимулируют спецификацию аксонов в нейритах развивающихся нейронов за счет активации белка-медиатора ответа коллапсина 2 (CRMP-2), который связывается с конусами роста аксонов способом, который ингибируется GSK3 (Jiang et al. др., 2005; Йошимура и др., 2005). Посредством активации mTORC1 передача сигналов AKT способствует росту множества популяций клеток мозга, включая нейроны и астроглиальные клетки, и играет критическую роль как в развитии мозга, так и в патологическом росте, лежащем в основе мегалэнцефалии и корковых пороков развития (Lipton and Sahin, 2014).Динамический процесс формирования синапсов (то есть синаптическая пластичность) жестко регулируется и необходим для установления правильных нейронных цепей и памяти. Активация передачи сигналов AKT и mTORC1 важна для контроля синаптической пластичности, влияя как на долгосрочную потенциацию (LTP), так и на долгосрочную депрессию (LTD) за счет индукции локализованного синтеза белка (Hou and Klann, 2004; Li et al. , 2010; Tang et al., 2002).
Нарушение регуляции сигнальной сети AKT лежит в основе многочисленных нарушений развития нервной системы, нейрокогнитивных, нервно-психических и нейродегенеративных заболеваний.Мутации зародышевой линии или соматической мозаики, приводящие к повышенной активации передачи сигналов PI3K-AKT-mTORC1, часто связаны с эпилепсией, расстройствами аутистического спектра и умственными недостатками, примером чего является многогранное заболевание TSC (Lipton and Sahin, 2014). Снижение передачи сигналов AKT было связано с рядом расстройств настроения, включая депрессию, шизофрению и биполярное расстройство. Считается, что депрессия вызвана локальным синаптическим дефицитом и связана со снижением передачи сигналов BDNF на AKT и mTORC1, что можно обратить вспять с помощью антидепрессантов, таких как кетамин (Abdallah et al., 2015). Повышенная активность GSK3 при ослаблении передачи сигналов AKT также способствует депрессии, а также шизофрении и биполярному расстройству (Emamian et al., 2004; Kaidanovich-Beilin and Woodgett, 2011). Мыши Gsk3α S21 или Gsk3β + S9 демонстрируют антидепрессивное поведение, которое имитирует поведение животных, принимающих литий, селективный ингибитор GSK3, используемый для лечения расстройств настроения. Пока Gsk3α S21A ; Мыши Gsk3β S9A имеют нормальное развитие (McManus et al., 2005), они чувствительны к гиперактивности с фенотипами, связанными с тревогой в ответ на изменения окружающей среды и стресс (Kaidanovich-Beilin, Woodgett, 2011; Polter et al., 2010). Различные исследования также связывают дисфункциональную передачу сигналов AKT и его последующих мишеней с нейродегенеративными заболеваниями, включая болезнь Альцгеймера. В мозгу терпеливых к болезни Альцгеймера передача сигналов AKT к GSK3 и mTORC1 кажется повышенной (An et al., 2003; Griffin et al., 2005). Было высказано предположение, что mTORC1-опосредованное ингибирование аутофагии может препятствовать очищению патологических белковых агрегатов при болезни Альцгеймера и других нейродегенеративных заболеваниях (Nixon, 2013).GSK3 вовлечен в болезнь Альцгеймера и непосредственно фосфорилирует несколько белков, которые вносят вклад в патологию заболевания, включая белок-предшественник амилоида, пресенилин и тау (Kaidanovich-Beilin and Woodgett, 2011) (). Однако неясно, влияет ли на эту функцию GSK3 передача сигналов AKT. Необходимы дополнительные исследования, чтобы понять роль членов семейства FOXO в нейродегенерации, поскольку появляется все больше доказательств того, что FOXO может способствовать удалению неправильно свернутых белков (Webb and Brunet, 2014).
Терапевтическое нацеливание AKT
Хотя очевидно, что передача сигналов PI3K-Akt влияет на широкий спектр заболеваний человека, терапевтическая разработка ингибиторов Akt в значительной степени ограничивается онкологией. Более 50% опухолей человека демонстрируют гиперактивацию AKT. За последнее десятилетие многочисленные специфические и сильные низкомолекулярные ингибиторы пути PI3K прошли клинические испытания. Использование in vitro двух ингибиторов PI3K, LY294002 и вортманнина, сыграло важную роль в расшифровке многих механизмов, с помощью которых PI3K инициирует передачу сигналов, включая активацию AKT.Однако последующие исследования показали, что оба соединения, помимо блокирования всех изоформ PI3K, также напрямую ингибируют mTOR, который является протеинкиназой, родственной PI3K (Brunn et al., 1996). Поскольку с тех пор были разработаны более специфические и сильные ингибиторы PI3K и AKT, настоятельно рекомендуется больше не использовать вортманнин и LY294002, чтобы делать конкретные выводы относительно функций PI3K или Akt. Некоторая эффективность и терапевтические преимущества наблюдались у пациентов, получавших новые классы ингибиторов PI3K, но их использование может быть ограничено из-за значительной токсичности (Mayer and Arteaga, 2016).Также были разработаны несколько низкомолекулярных ингибиторов AKT, которые в настоящее время проходят клиническую оценку.
Разработано большое количество АТФ-конкурентных ингибиторов AKT. Учитывая высокую степень сходства АТФ-связывающего кармана среди киназ семейства AGC, неудивительно, что отсутствие специфичности является основным препятствием для ингибиторов активного сайта. GSK6 ингибирует все изоформы AKT и продемонстрировал эффективность в ряде доклинических исследований, но ограничивающая дозу токсичность, которая, вероятно, поражает мишень, связанная с гипергликемией, привела к прекращению клинической разработки этого препарата (Crouthamel et al., 2009; Rhodes et al., 2008). AZD5363 представляет собой наномолярный ингибитор пан-AKT, который показал эффективность в ряде моделей гематологического рака и солидных опухолей (Crabb et al., 2017; Davies et al., 2012). Одним из наиболее клинически продвинутых каталитических ингибиторов является GDC0068 (ипатасертиб), высокоэффективный и специфический пероральный биодоступный ингибитор всех трех изоформ AKT. Хотя GDC0068 продемонстрировал эффективность на доклинических моделях с инактивацией PTEN или мутацией PIK3CA (Lin et al., 2013), испытание фазы I не выявило значительной противоопухолевой активности (Saura et al., 2017). Афуресертиб или GSK2110183, который ингибирует AKT1 в субнаномолярном диапазоне и AKT2 и AKT3 в низком наномолярном диапазоне, также показал высокую активность в доклинических моделях и в испытаниях фазы I, по-видимому, хорошо переносится (Dumble et al., 2014).
Каталитические ингибиторы AKT блокируют фосфорилирование нижележащих субстратов дозозависимым образом, но фактически защищают AKT от дефосфорилирования по T308 и S473 (Lin et al., 2012; Okuzumi et al., 2009). Более того, каталитические ингибиторы AKT фактически усиливают связывание PI3,4P 2 и PIP 3 , поскольку киназа принимает конформацию, при которой домен PH высвобождается из его ингибирующих взаимодействий с каталитическим доменом, что приводит к усиленному связыванию с мембраной (Vivanco et al. ., 2014). При прямом сравнении каталитические ингибиторы демонстрируют меньшую эффективность в стимулировании гибели клеток, чем аллостерические ингибиторы, нацеленные на домен PH (Vivanco et al., 2014) (см. Ниже).
MK2206 — это специфический, мощный и биодоступный при пероральном приеме аллостерический ингибитор AKT, который нацелен как на PH, так и на каталитические домены (Hirai et al., 2010) и вызывает устойчивую гибель раковых клеток как отдельно, так и в сочетании с другими соединениями (Wisinski et al., 2016). Однако в качестве монотерапии MK2206 не показал значительной эффективности в клинике (Ma et al., 2016). В отличие от каталитических ингибиторов, аллостерические ингибиторы нацелены на закрытую, неактивную конформацию AKT, где домен PH взаимодействует с доменом киназы, тем самым предотвращая фосфорилирование и активацию (Barnett et al., 2005; Hirai et al., 2010). В соответствии с представлением о том, что мутация AKT E17K конститутивно связана с мембраной, этот онкогенный аллель AKT менее чувствителен к MK2206 (Parikh et al., 2012). Наконец, ARQ092 является структурно отличным аллостерическим ингибитором, который нацелен на все три изоформы AKT, сильно ингибирует передачу сигналов AKT и в настоящее время оценивается в фазе I исследований (Lapierre et al., 2016; Ю. и др., 2015).
На сегодняшний день как каталитические, так и аллостерические ингибиторы показали ограниченную эффективность в клинике. Возможным фактором, способствующим отсутствию значительных противоопухолевых ответов, наблюдаемых для всех ингибиторов AKT, является отсутствие стратификации пациентов для тех, у кого были активирующие мутации AKT или PIK3CA в соответствующих испытаниях. В исследованиях, в которых пациенты были отобраны на предмет наличия мутаций пути, например мутации AKT1 E17K, у ряда пациентов наблюдались частичные ответы при лечении AZD5363 (Davies et al., 2012). Более того, снятие ингибирования обратной связи в опухолях, обработанных ингибиторами AKT, приводит к эффекту отскока, приводящему к устойчивой активации пути PI3K, тем самым ограничивая эффективность таких ингибиторов, по крайней мере, в качестве отдельных агентов (Chandarlapaty et al., 2011). Важно отметить, что мутации пути PI3K, такие как онкогенный PIK3CA, не всегда совпадают с повышенным фосфорилированием AKT, с другими эффекторами PI3K, такими как изоформы SGK, управляющие нисходящей передачей сигналов в некоторых условиях (Vasudevan et al., 2009). Возникновение устойчивости к ингибиторам AKT представляет собой серьезную проблему для эффективного применения низкомолекулярных ингибиторов, нацеленных на сеть PI3K-AKT у пациентов. Эти механизмы устойчивости включают повышенную экспрессию изоформ SGK (Bago et al., 2016; Sommer et al., 2013), что дополнительно иллюстрирует проблему преодоления регуляторной избыточности в сети (см. Выше).
Несмотря на специфические функции и субстраты, приписываемые трем изоформам AKT в патобиологии, высокоселективные и мощные ингибиторы, специфичные для изоформ AKT, еще не разработаны.Основываясь на наших знаниях о функциях Akt, специфичных для изоформ, оптимизация ингибиторов Akt для сохранения AKT2 может быть особенно эффективной для снижения основной токсичности гипергликемии в отношении мишеней в условиях рака, где AKT1 или 3 являются основными факторами.
Пирофосфаты инозита и Akt / PKB: Являются ли β-клетки поджелудочной железы исключением из правил?
https://doi.org/10.1016/j.cellsig.2019.02.003Получить права и контентОсновные моменты
- •
Подавление IP6K1 ингибирует индуцированную глюкозой активацию Akt / PKB в β-клетках поджелудочной железы.
- •
Пан-ингибитор IP6K, TNP, также снижает стимулированное глюкозой фосфорилирование Akt / PKB.
- •
Ингибирование IP6K1 нарушает Akt / PKB, сокращая секрецию инсулина и его аутокринную обратную связь.
- •
Есть как положительные, так и отрицательные действия IP 7 на Акт / ПКБ.
- •
Доминирующее положительное действие IP 7 на Akt / PKB обусловлено уникальной аутокринной обратной связью инсулина.
Abstract
Инозитолпирофосфат, дифосфоинозитолпентакисфосфат (IP 7 ), как полагают, отрицательно регулирует критический белок передачи сигналов инсулина Akt / PKB. Нокдаун IP 7 -генерирующей инозитол-гексакисфосфаткиназы 1 (IP6K1) приводит к сопутствующему усилению передачи сигналов через Akt / PKB в большинстве изученных до сих пор типов клеток. Общий нокаут in vivo IP6K1 связан с фенотипом, устойчивым к диете с высоким содержанием жиров, из-за усиленной передачи сигналов Akt / PKB в классических регулируемых инсулином тканях, противодействуя инсулинорезистентности.Напротив, мы показали важную положительную роль IP6K1 в экзоцитозе инсулина в β-клетках поджелудочной железы. Эти клетки также обладают функциональными рецепторами инсулина, и петля обратной связи после секреции инсулина является ключевым аспектом их нормальной функции. Таким образом, мы исследовали влияние подавления IP6K1 на активацию Akt / PKB в β-клетках. Молчание снижает стимулированное глюкозой увеличение фосфорилирования Akt / PKB на T308 и S473. Эти эффекты были воспроизведены с помощью селективного ингибитора пан-IP6K TNP.Вероятное объяснение снижения IP 7 , , уменьшения , а не , увеличения фосфорилирования Akt / PKB, заключается в том, что IP 7 отвечает за генерацию инсулинового сигнала, который является основным источником активации Akt / PKB. В соответствии с этим, активация рецептора инсулина была нарушена в клетках, обработанных TNP. Чтобы проверить, сохраняется ли механизм ингибирования Akt / PKB IP 7 в β-клетках, мы обрабатывали их базальной глюкозой с концентрацией инсулина, эквивалентной концентрации, достигнутой во время стимуляции глюкозой.TNP усиливал фосфорилирование Akt / PKB Т308, индуцированное экзогенным инсулином. Таким образом, IP 7 регуляция β-клеток Akt / PKB определяется двумя противоположными силами: прямым ингибированием Akt / PKB по сравнению с непрямой стимуляцией посредством секретируемого инсулина. Последний механизм является доминирующим, маскируя тормозной эффект. Следовательно, фармакологические стратегии для подавления активности IP6K могут не иметь такого же положительного выхода в β-клетках, как в других регулируемых инсулином тканях.
Ключевые слова
Akt / PKB
Инозитол гексакисфосфаткиназа 1
Дифосфоинозитол пентакисфосфат / IP 7
Бета-клетки поджелудочной железы
Инсулиновые сигналы Авторские статьи (
9000)Опубликовано Elsevier Inc.Рекомендуемые статьи
Цитирующие статьи
Akt / PKB Sampler Kit
Akt / протеинкиназа B (PKB) представляет собой регулируемую фактором роста Ser / Thr-киназу, которая играет центральную роль в пути передачи сигналов инсулина и индукции синтеза гликогена. Изучение PKB ускорило выяснение полного пути, который объясняет индуцированные инсулином биологические эффекты. Лигирование рецептора инсулина и активация киназы Tyr рецептора инсулина приводит к быстрому привлечению фосфоинозитид-3-киназы (PI3K) в ассоциированные с рецептором сигнальные комплексы, которые включают субстрат тирозинкиназы рецептора инсулина, IRS-1.Активация PI3K приводит к выработке фосфатидилинозитид (3,4,5) трифосфата (PIP3), который действует как инсулино-индуцированный секундомер. Другой фермент этого пути, 3-фосфоинозитид-зависимая протеинкиназа (PDPK1), активирует PKB в присутствии PIP3. PKB имеют C-концевой каталитический домен и N-концевой некаталитический домен гомологии плекстрина (PH). Связывание продуктов фосфатидилинозитол (3,4) бисфосфата (PIP2) и PIP3 с доменом PH PKB вызывает его перемещение на плазматическую мембрану, где фосфорилирование PDPK1 и другими киназами приводит к активации PKB.PKB, в свою очередь, инактивирует киназу гликогенсинтазы (GSK3). Это приводит к дефосфорилированию (активации) гликогенсинтазы и последующему производству гликогена. PDPK1, PKB и GSK3 регулируют различные физиологические процессы посредством фосфорилирования множества внутриклеточных мишеней. Другие киназы Ser / Thr, регулируемые ниже PI 3-киназ, включают изоформы PKC (PKC λ / ι и ξ), киназу p70 S6 и PKA. Таким образом, PKB и ряд других киназ и сигнальных факторов важны для внутриклеточной трансдукции индуцированных инсулином сигналов и антиапоптотических эффектов множества факторов выживания.
Эти антитела обычно тестируются с помощью вестерн-блоттинга. Другие приложения были протестированы в BD Biosciences Pharmingen только во время разработки антител или опубликованы в литературе.
PKB более эффективен, чем PKB в усилении мышечно-специфического гена …
La transition épithélio-mésenchymateuse (EMT) — это необратимый процесс в нормальном и патологическом контексте, при гаструляции, органогенезе, фиброзе и раке.Эта трансформация épithéliale cellule mesenchymateuse является неотъемлемой частью приобретения propriétés migratoires et est généralement associée в un changement de destin cellulaire. Différentes voies moléculaires sont impliquées selon le context de l’EMT концерн. Récemment, notre labratoire a mis en évidence que la voie Notch cytoplasmique contrôle l’EMT des cellules de la lèvre dorso-mediale du somite (DML). Les crêtes neurales exprimant DLL1, активный «на проходе» для получателя NOTCH, свободный внутренний внутрицитоплазматический домен NOTCH (NICD).В цитоплазме NICD ингибирует киназу GSK3ß, способствует стабилизации SNAIL, является основным фактором перехода между эпителием и мезенхиматозом. После освобождения катенин-де-ла-могенез, после транслокации в нояу, активная транскрипция генов миогенеза (Myf5). Ainsi, l’activation de la voie Notch cytoplasmique permet une индукции concomitante de l’EMT et de la myogénèse. La fonction cytoplasmique de Notch reste controversée et le mécanisme par lequel NICD ингибирует GSK3ß reste obscur.В процессе лечения этим препаратом, устраняющим эффект меканизма, ингибирует NICD l’activité kinase de GSK3ß. Подтвердите взаимодействие GSK3ß и NICD и управляющее взаимодействие через CoIP. После избегания импликации киназы сыворотки крови AKT в миогенезе клеток DML, как результат, через CoIP и электропорацию, подавление GSK3 в NICD является средством подтверждения для AKT, Это подразумевается в EMT и в парах фосфорилирования GSK3ß.В сравнении с NICD1 в пуле и 4 NICD в исходном состоянии, мы наблюдаем за проявлением экзогенного состояния 5 молекул, индуцирующего EMT и дифференциацию myogénique de manière similaire. J’ai aussi montré que parmi des différents domaines de NICD, le domaine RAM, connu pour se lier à l’ADN (via RBPJ), is nécessaire et Suffisant à l’inhibition de GSK3ß. Во-вторых, это тестер импликации voie Notch cytoplasmique dans d’autres context d’EMT. Pour ce faire, j’ai mis en évidence que cette voie est impliquée dans les autres lèvres du dermomyotome mais aussi dans les crêtes neurales, qui délaminent du toit du tube neural.В частности, обнаружено, что ко-активация voies Wnt et Notch, ингибирование киназы GSK3ß par NICD cytoplasmique ainsi qu’une inhibition de la différenciation en présence d’une ß-катенина муте, повторяется на мембране, ou en présence d’une molécule SNAIL2 доминантно-отрицательный. Le dernier ax de ma thèse состоит из élucider le mécanisme de régulation de l’induction de l’EMT et de la myogenèse через активацию NICD. Это неверное свидетельство того, что клетки DML являются активными в рамках DLL1 и имеют массивное надежное выражение NICD в DML, вызванном массовым распространением и расширением группы программных клеток.Если детерминатор si la régulation de cette initiation se fait avant или après индукция де NICD, j’ai créé un плазмидный перметант для ответа на этот вопрос и afin de visualiser son expression in vivo, j’ai initié une сотрудничества avec une équipe de l ILM afin de créer un микроскоп вертикальный бифотонный перметант SPIM для наблюдения за зародышами пулеток [и т.д.]
Протеинкиназа Akt1 PKB альфа | AKT1 Белок
О протеинкиназе Akt1 / PKB альфа:
Белок киназы Akt1 альфа (часто называемый PKB) представляет собой человеческий фермент, принадлежащий к семейству AKT Sh3 (Src homology 2-like) -содержащих серин / треониновых киназ.Он также известен как AKT1, AKT, CWS6, PKB, PKB-ALPHA, PRKBA, RAC, RAC-ALPHA, AKT серин / треониновая киназа 1. Он идентифицирован как онкоген в ретровирусе.
Киназа Akt1 / PKB альфа Функция
AKT1 является каталитически неактивным геном в фибробластах с недостатком сыворотки и родственен AKT2. И AKT1, и AKT2 активируются фактором роста тромбоцитов. Быстрая активация AKT1, которая происходит через фосфатидилинозитол-3-киназу, отменяется мутациями в домене гомологии плекстрина.
AKT является критическим медиатором выживания нейронов нервной системы, вызванного фактором роста, который может подавлять апоптоз (самоуничтожение клеток) путем активации серин / треонинкиназы, которая затем фосфорилирует и инактивирует компоненты апоптозного аппарата. . Исследования на мышах показывают, что AKT1 отвечает за стимуляцию роста (у мышей без него происходит снижение на 25%) через рецептор IG1, в то время как мыши без гена также проявляют устойчивость к раку, особенно в отношении замедленного роста опухоли.Поскольку AKT1 является членом класса генов, известных как онкогены, мутации могут привести к тому, что нормальные клетки станут злокачественными.
Киназа Akt1 / PKB альфа Структура и взаимодействия
AKT1 имеет цитогенетическое расположение 14q32.33 в положении 32.33 хромосона 14. На молекулярном уровне его пары оснований от 104 769 349 до 104 795 748. Номер его проекта базы данных ансамбльного генома — ENSG00000142208, а его UniProt — P31749.
ATK1 взаимодействует со следующими белками; AKTIP, BRAF, BRCA1, C-RA, CDKN1B, CHUK, GAB2, HSP90AA1, ILK, KRT10, MAP2K4, MAP3K11, MAP3K8, MAPK14, MAPKAPK2, MARK2, MTCP1, MTOR, NP1, NR3CK, NR3CK1, NR3CK1, NR3CK1 PLXNA1, TCL1A, TRIB3, TSC1, TSC2 и YWHAZ.
Протеинкиназа также взаимодействует с молекулами ниже дофаминового рецептора D2. Его список кодировщиков ортологов PBD — это PDBe RCSB, в то время как идентификаторы PBD включают; 1h20, 1UNP, 1UNQ, 1UNR, 2UVM, 2UZR, 2UZS, 3CQU, 3CQW, 3MV5, 3MVH, 3O96, 3OCB, 3OW4, 3QKK, 3QKL, 3QKM, 4EJN, 4EKK, 4EKL, 4GV1.
Киназа Akt1 / PKB альфа Механизмы
Белок AKT1 является важным геном для роста массы у людей. Его роль в регулировании роста и деления (пролиферации), дифференцировки и выживания клеток поддерживается межклеточной связью между нервными клетками. клетки (нейроны) и формирование воспоминаний.
AKT1 связан с различными состояниями здоровья и генетическими изменениями, не только с синдромом Протея. Исследования показали, что вариации полиморфизма в гене AKT1 чаще встречаются у пациентов с шизофренией, чем у людей без этого заболевания. Изменения полиморфизма затронули нуклеотиды (ДНК) в AKT1, что потенциально могло изменить функцию киназы AKT1.
Раковые опухоли также растут частично из-за взаимодействия AKT1 с другими генами. Рак яичников — это особо заслуживающий внимания тип заболевания, на которое влияют мутации, вызванные AKT1.Также предполагается, что механизмы ассоциированных рецепторов взаимодействуют с каннабисом, что влияет на симптомы шизофрении, упомянутые выше.
сигнальный путь клеток Akt / PKB — антитела Novex®, ELISA и тесты Luminex® | Thermo Fisher Scientific
Серин-треонинкиназа Akt (также известная как протеинкиназа B (PKB) играет важную роль в широко влиятельной сигнальной сети. Активация Akt служит главным переключателем клеточных сигнальных путей, генерируя множество внутриклеточных ответов через нижележащие цели и взаимодействующих партнеров.Akt участвует в различных заболеваниях, от рака и диабета до нейродегенерации. Akt — одна из наиболее активно изучаемых киназ как в фундаментальных исследованиях, так и при разработке лекарств. Мы предлагаем широкий спектр продуктов, чтобы помочь в исследовании Akt.
Akt / PKB экспрессируется в виде трех изоформ [1]
Общие мишени в пути Akt / PKB:
Аминоконцевой домен гомологии плекстрина (PH), центральный серин-треониновый каталитический домен и небольшой карбокси терминальный регуляторный домен характеризует все три изоформы.Домен PH связывается с фосфатидилинозитол-3,4-бисфосфатом (PIP2) и фосфатидилинозитол-3,4,5-трифосфатом (PIP3), продуктами PI3K. Это связывание заставляет Akt локализоваться на плазматической мембране, где он фосфорилируется фосфоинозитид-зависимой киназой 1 (PDK1) на Thr308 в петле активации каталитического домена. Это фосфорилирование приводит к активации. Полная активация требует фосфорилирования по второму сайту (Ser473).
Комплекс mTOR-rictor (mTORC2) является первичной киназой для второго события фосфорилирования, хотя другие киназы, такие как Ilk (интегрин-связанная киназа) [2, 3] , PDK1 [4, 5] , ДНК-зависимая протеинкиназа (ДНК-PK) [6, 7] и ATM (мутированная атаксия, телеангиэктазия) также были идентифицированы [8] .
Аномальная активация или блокировка пути Akt / PKB влияет на выживаемость и пролиферацию опухолевых клеток. Таким образом, путь Akt является привлекательной мишенью для открытия противораковых лекарств [9] . Ключевые мишени для подавления опухоли включают PH-домен, богатый лейцином повторяющийся протеин-фосфатазу (PHLPP), фосфатазу и гомолог тензина (PTEN) и комплекс туберозного склероза (TSC) [10].
 Бизнес-Блог Блоготей Бизнес-Блог «Блоготей» — информационный блог о бизнесе и финансах. Полезные статьи и новости из мира бизнеса, финансов, банков, экономики, инвестиций.
Бизнес-Блог Блоготей Бизнес-Блог «Блоготей» — информационный блог о бизнесе и финансах. Полезные статьи и новости из мира бизнеса, финансов, банков, экономики, инвестиций. 